Diferencia entre isótopos e isómeros

Isótopos vs isómeros
Hay variaciones entre diferentes átomos. Además, hay variaciones dentro de los mismos elementos. Los isótopos son ejemplos de diferencias dentro de un solo elemento.
Una molécula o ion que tiene la misma fórmula molecular puede existir de diferentes maneras dependiendo de las órdenes de enlace, las diferencias de distribución de carga, la forma en que se organizan en el espacio, etc. Estos se conocen como isómeros.
Isótopos
Los átomos del mismo elemento pueden ser diferentes. Estos diferentes átomos del mismo elemento se llaman isótopos. Son diferentes entre sí al tener diferentes números de neutrones. Dado que el número de neutrones es diferente, su número de masa también difiere. Sin embargo, los isótopos del mismo elemento tienen el mismo número de protones y neutrones. Diferentes isótopos presentes en cantidades variables, y esto se da como un valor porcentual llamado abundancia relativa. Por ejemplo, el hidrógeno tiene tres isótopos como protio, deuterio y tritio. Su número de neutrones y abundancias relativas son las siguientes.
1H - Sin neutrones, la abundancia relativa es 99.985%
2H- Un neutrón, la abundancia relativa es 0.015%
3H- Dos neutrones, la abundancia relativa es del 0%
El número de neutrones que un núcleo puede contener difiere de un elemento a otro. Entre estos isótopos, solo algunos son estables. Por ejemplo, el oxígeno tiene tres isótopos estables, y el estaño tiene diez isótopos estables. La mayoría de las veces, los elementos simples tienen el mismo número de neutrones que el número de protones pero, en elementos pesados, hay más neutrones que los protones. El número de neutrones es importante para equilibrar la estabilidad de los núcleos. Cuando los núcleos son demasiado pesados, se vuelven inestables y, por lo tanto, esos isótopos se están volviendo radiactivos. Por ejemplo, 238 U emite radiación y decae a núcleos mucho más pequeños. Los isótopos pueden tener diferentes propiedades debido a sus diferentes masas. Por ejemplo, pueden tener diferentes giros, por lo que sus espectros de RMN difieren. Sin embargo, su número de electrones es similar dar lugar a un comportamiento químico similar.
Se puede usar un espectrómetro de masas para obtener información sobre los isótopos. Da la cantidad de isótopos que tiene un elemento, sus abundancias y masas relativas.
Isómeros
Los isómeros son compuestos diferentes con la misma fórmula molecular. Hay varios tipos de isómeros. Los isómeros se pueden dividir principalmente en dos grupos como isómeros constitucionales y isómeros estéreo. Los isómeros constitucionales son isómeros donde la conectividad de los átomos difiere en las moléculas. El butano es el alcano más simple para mostrar el isomerismo constitucional. Butane tiene dos isómeros constitucionales, Butano mismo e Isobuteno.
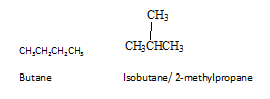
En los átomos estéreo-isómeros están conectados en la misma secuencia, a diferencia de los isómeros constitucionales. Los estereoisómeros difieren solo en la disposición de sus átomos en el espacio. Los estereoisómeros pueden ser de dos tipos, enantiómeros y diastereómeros. Los diastereómeros son estereoisómeros cuyas moléculas no son las imágenes del espejo entre sí. Los isómeros trans de 1,2-dicloroeteno son diastereómeros. Los enantiómeros son estereoisómeros cuyas moléculas son imágenes de espejo no superposibles entre sí. Los enantiómeros ocurren solo con moléculas quirales. Una molécula quiral se define como una que no es idéntica con su imagen de espejo. Por lo tanto, la molécula quiral y su imagen de espejo son enantiómeros entre sí. Por ejemplo, la molécula de 2-butanol es quiral, y sus imágenes de espejo son enantiómeros.
| Cuál es la diferencia entre Isótopos e isómeros? • Los isótopos son átomos diferentes del mismo elemento. Los isómeros son compuestos diferentes con la misma fórmula molecular. • Los isótopos difieren entre sí debido al número de neutrones, mientras que los isómeros difieren entre sí debido a la disposición de los átomos. • Los isótopos de un solo elemento tienen el mismo comportamiento químico, pero las propiedades físicas pueden diferir. Los isómeros con la misma fórmula química tienen diferencias en las propiedades químicas y físicas (excepto algunos isómeros). |


