Diferencia entre kd y km
Diferencia clave: KD vs KM
KD y KM son constantes de equilibrio. La diferencia clave entre kd y km es que KD es una constante termodinámica, mientras que KM no es una constante termodinámica.
KD se refiere a la constante de disociación, mientras que el km es el Michaelis constante. Ambas constantes son muy importantes en el análisis cuantitativo de las reacciones enzimáticas.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es kd
3. Que es km
4. Comparación de lado a lado - KD vs Km en forma tabular
5. Resumen
Que es kd?
KD es constante de disociación. También se conoce como Constante de disociación de equilibrio Debido a su uso en los sistemas de equilibrio. La constante de disociación es la constante de equilibrio de las reacciones donde un compuesto grande se convierte en componentes pequeños de manera reversible. El proceso de esta conversión también se conoce como disociación. Una molécula iónica siempre se disocia en sus iones. Entonces la constante de disociación o KD es una cantidad que expresa la medida en que una sustancia particular en solución se disocia en iones. Por lo tanto, esto es igual al producto de las concentraciones de los iones respectivos divididos por la concentración de la molécula no disociada.
AB ↔ A +B
En la reacción general anterior, la constante de disociación, KD se puede administrar como se muestra a continuación.
Kd = [a] [b] / [ab].
Además, si hay una relación estequiométrica, uno debe incluir los coeficientes estequiométricos en la ecuación.
xab ↔ aa +bb
La ecuación de la constante de disociación, KD para la reacción anterior es la siguiente:
Kd = [a]a[B]b / [AB]X
Específicamente, en aplicaciones bioquímicas, KD ayuda a determinar la cantidad de productos dados por una reacción química en presencia de una enzima. El KD de una reacción enzimática expresa la afinidad del receptor de ligando. En otras palabras, establece la capacidad de un sustrato para dejar el receptor de una enzima. Por otro lado, describe cuán fuertemente un sustrato se une a la enzima.
Que es km?
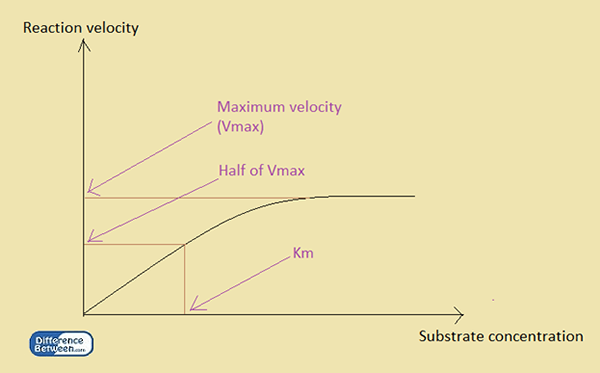
Km es la constante de Michaelis. A diferencia de KD, KM es una constante cinética. Su aplicación principal es en la cinética enzimática, es decir, determinar la afinidad de un sustrato para unirse con una enzima. La constante se expresa relacionando la concentración del sustrato con la velocidad de reacción en presencia de una enzima. En consecuencia, el Michaelis constante o KM es la concentración del sustrato cuando la velocidad de la reacción alcanza la mitad de su velocidad máxima.

Figura 1: La relación entre la velocidad de reacción y la concentración de sustrato en una reacción enzimática.
Durante una reacción entre la enzima (E) y el sustrato (s), la formación de productos (P) es la siguiente:
E + S ↔ E-S Complex ↔ E + P
Si las constantes de equilibrio de la reacción anterior son las siguientes, puede derivar km de estas constantes.
Km = k-1 + K+2 /K+1
Determinación de KM según el concepto de Michael
Michaelis desarrolló una relación utilizando la concentración de sustrato, [S] y la velocidad de reacción máxima, VMAX. La relación entre la concentración del sustrato y el km de una reacción enzimática es la siguiente:
v = vmax [s] / km + [s]
v es la velocidad en cualquier momento, mientras que [s] es la concentración del sustrato en un momento particular, y Vmax es la velocidad máxima de la reacción. KM es el Michaelis constante para la enzima en la reacción. El valor de la constante de Michaelis depende de la enzima. En consecuencia, un pequeño valor de km indica que la enzima se satura con una pequeña cantidad de sustrato. Entonces el VMAX se obtiene a una concentración de sustrato baja. En contraste, un valor de alto km indica que la enzima requiere una gran cantidad de sustrato para saturarse.
¿Cuál es la diferencia entre kd y km??
Kd vs km | |
| KD es la constante de disociación. | Km es la constante de Michaelis. |
| Naturaleza | |
| KD es una constante termodinámica. | KM es una constante cinética. |
| Detalles | |
| KD representa la afinidad de un sustrato hacia una enzima. | KM representa la relación entre la concentración del sustrato y la velocidad de reacción. |
Resumen - KD vs KM
KD y KM son constantes de equilibrio que describen propiedades de las reacciones enzimáticas. La diferencia clave entre KD y KM es que KD es una constante termodinámica, mientras que KM no es una constante termodinámica.
Referencia:
1. "Cinética de Michaelis-Menten."Wikipedia, Fundación Wikimedia, 10 de abril. 2018, disponible aquí.
2. "Introducción a las enzimas."Concentración de sustrato (Introducción a las enzimas), disponibles aquí.
3. "Constante de disociación."Wikipedia, Fundación Wikimedia, 10 de abril. 2018, disponible aquí.


