Diferencia entre quinasa y fosfatasa
Quinasa vs fosfatasa
La diferencia entre la quinasa y la fosfatasa se deriva del hecho de que estas dos enzimas admiten dos procesos opuestos. La quinasa y la fosfatasa son dos enzimas importantes que se ocupan de los fosfatos encontrados en los sistemas biológicos. Las enzimas son proteínas globulares tridimensionales que actúan como catalizadores biológicos para muchas reacciones bioquímicas en las células. Debido a esta capacidad, la llegada de enzimas se consideró como uno de los eventos más importantes en la evolución de la vida. Las enzimas aumentan la tasa de reacciones bioquímicas al estresar enlaces químicos específicos. Quinasa y fosfatasa son dos enzimas esenciales involucradas en el fosforilación de proteínas. La fosforilación de las proteínas facilita las funciones clave de las proteínas, incluido el metabolismo celular, la diferenciación celular, la transducción de señales durante el crecimiento, la transcripción, la respuesta inmune, etc. La fosforilación de proteínas implica los cambios conformacionales de las moléculas de proteína mediante la adición del grupo de fosfato de las moléculas de ATP, mientras que la desfosforilación implica la eliminación de grupos de fosfato de la proteína. Los procesos de fosforilación y desfosforilación son catalizados por las enzimas de quinasa y fosfatasa respectivamente. En este artículo, la diferencia entre quinasa y fosfatasa se discutirá destacando los hechos importantes sobre la quinasa y la fosfatasa.
¿Qué es la quinasa??
Las quinasas son Grupo de enzimas que catalizan las reacciones de fosforilación mediante la adición de grupos de fosfato de ATP a moléculas de proteínas. La reacción de fosforilación es unidireccional debido a la liberación de energía masiva con la descomposición del enlace fosfato-fosfato en ATP para producir ADP. Existen muchos tipos diferentes de proteínas quinasas y cada quinasa es responsable de la fosforilación de una proteína o un conjunto de proteínas específicas. Sin embargo, al considerar la estructura de aminoácidos en general, las quinasas pueden agregar grupos de fosfato a tres tipos de aminoácidos, que consisten en un grupo OH como parte de su grupo R. Estos tres aminoácidos son serina, treonina y tirosina. Las proteínas quinasas se clasifican en función de estos tres sustratos de aminoácidos. La clase de serina/ treonina quinasa se asemeja a las proteínas más citoplasmáticas. Durante el proceso de fosforilación, la quinasa puede mejorar o reducir la actividad de la proteína. Sin embargo, la actividad depende del sitio de la fosforilación y la estructura de la proteína fosforilada.
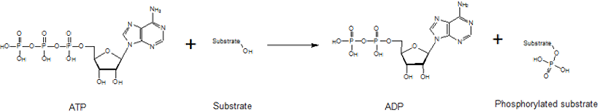
Reacción de fosforilación básica
¿Qué es la fosfatasa??
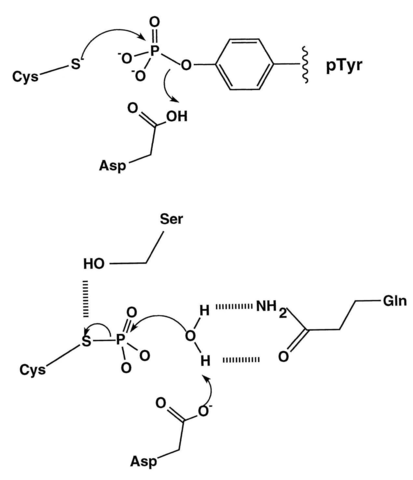
La reacción inversa de la fosforilación, el La desfosforilación es catalizada por las enzimas de fosfatasa. Durante la desfosforilación, la fosfatasa elimina los grupos de fosfato de las moléculas de proteínas. Por lo tanto, una proteína activada por una quinasa puede desactivarse por una fosfatasa. Sin embargo, la reacción de desfosforilación no es reversible. Hay muchas fosfatasas diferentes que se encuentran en las células. Algunas fosfatasa son altamente específicas y desfosforilan una o pocas proteínas, mientras que otras eliminan el fosfato en una amplia gama de proteínas. Los fosfatos son hidrolasas, ya que usan la molécula de agua para la desfosforilación. Según la especificidad del sustrato, las fosfatasas pueden ser categorizado en cinco clases a saber; Fosfatasas específicas de tirosina, fosfatasas específicas de serina/treonina, fosfatasas de especificidad dual, histidina fosfatasas y fosfatasas lipídicas.

Mecanismo de desfosforilación de tirosina por un CDP
¿Cuál es la diferencia entre quinasa y fosfatasa??
• Las enzimas quinasa catalizan la fosforilación de proteínas mediante la adición de grupos de fosfato de las moléculas de ATP. Las enzimas de fosfatasa catalizan las reacciones de desfosforilación mediante la eliminación de grupos de fosfato de proteínas.
• La quinasa utiliza ATP para obtener grupos de fosfato, mientras que la fosfatasa usa moléculas de agua para eliminar grupos de fosfato.
• Las proteínas activadas por una quinasa pueden desactivarse por una fosfatasa.
Imágenes Cortesía:
- Reacción de fosforilación básica por BDOC13 (CC BY-SA 3.0)
- Mecanismo de desfosforilación de tirosina por un CDP por omosfilo (CC BY-SA 3.0)


