Diferencia entre la quinasa y la fosforilasa
Diferencia clave: quinasa vs fosforilasa
Tanto la quinasa como la fosforilasa son enzimas que tratan con el fosfato, aunque hay una diferencia en su función y naturaleza. La diferencia clave entre ellos es que, La quinasa es una enzima que cataliza la transferencia de un grupo de fosfato de la molécula de ATP a una molécula especificada, mientras que la fosforilasa es una enzima que introduce un grupo de fosfato en una molécula orgánica, particularmente glucosa. Este artículo le presentará enzimas quinasa y fosforilasa que tratan con fosfato y explicarán cuáles son las diferencias entre la quinasa y la fosforilasa.
¿Qué es la fosforilasa??
Fosforilasas fueron descubiertas por Earl W. Sutherland JR. A fines de la década de 1930. Estas enzimas catalizan la adición de un grupo de fosfato de un fosfato inorgánico o fosfato+hidrógeno a un aceptador de una molécula orgánica. Como ejemplo, la glucógeno fosforilasa puede catalizar la síntesis de glucosa-1-fosfato de un glucano que incluye un glucógeno, almidón o molécula de maltodextrina. La reacción se conoce como fosforólisis que también es similar a una hidrólisis. Sin embargo, la única diferencia es que es un fosfato, no una molécula de agua que se coloca en el enlace.
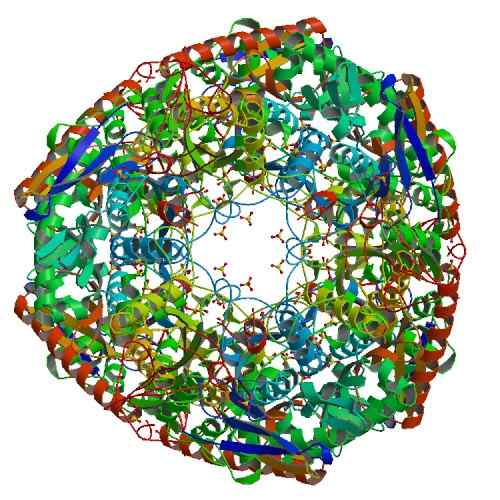
Estructura de la polinucleótido fosforilasa
¿Qué es la quinasa??
La enzima quinasa puede catalizar la transferencia de grupos de fosfato de moléculas de alta energía y donantes de fosfato a sustratos particulares. Este proceso se identifica como fosforilación cuando el sustrato gana un grupo de fosfato y la molécula de alta energía de ATP dona un grupo de fosfato. En este proceso de fosforilación, las quinasas juegan un papel importante, y es parte de la familia más grande de fosfotransferasas. Por lo tanto, las quinasas son muy importantes en el metabolismo celular, la regulación de proteínas, el transporte celular y numerosas vías celulares.

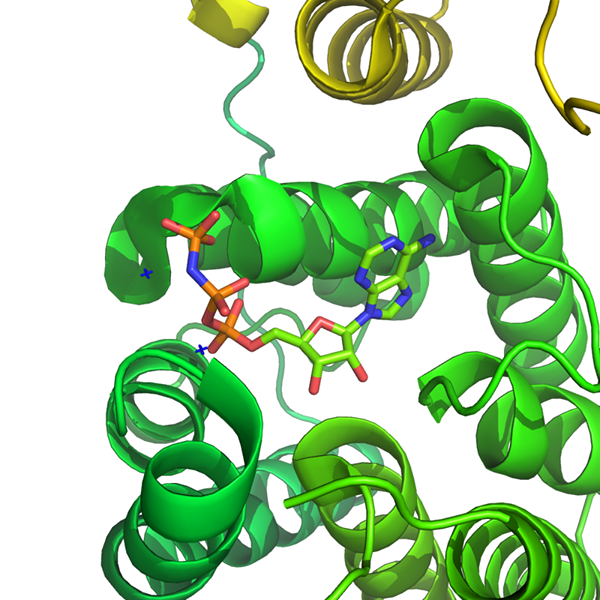
Dihidroxiacetona quinasa en complejo con un análogo ATP no hidrolizable
¿Cuáles son las diferencias entre la quinasa y la fosforilasa??
Definicion de Quinasa y fosforilasa
Quinasa: La quinasa es una enzima que cataliza la transferencia de grupos de fosfato de moléculas de alta energía y donantes de fosfato a sustratos particulares.
Fosforilasa: La fosforilasa es una enzima que cataliza la adición de un grupo de fosfato de un fosfato inorgánico o fosfato+hidrógeno a un aceptador de la molécula orgánica.
Características de Quinasa y fosforilasa
Mecanismo de acción
Quinasa: Catalizar la transmisión de un grupo de fosfato terminal de ATP a un grupo -OH en un sustrato. Producir así un enlace de éster fosfato en el producto. La reacción se conoce como fosforilación, y la reacción general se escribe como,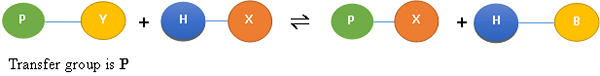
Fosforilasa: Catalizar la introducción de un grupo de fosfato en una molécula orgánica. La reacción se conoce como un fosforysis y la reacción general se escribe como,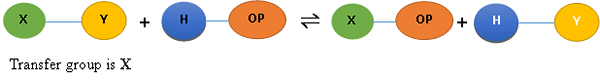
Donante de fosfato en la reacción de las enzimas quinasa y fosforilasa
Quinasa: Grupo de fosfato de la molécula ATP
Fosforilasa: Grupo de fosfato de fosfato inorgánico
Sustrato de enzimas quinasa y fosforilasa
Quinasa: Moléculas orgánicas específicas como carbohidratos, proteínas o lípidos
Fosforilasa: Molécula orgánica principalmente glucosa
Productos finales de las enzimas de quinasa y fosforilasa
Quinasa: ADP (molécula de energía) + sustrato fosforilado
Fosforilasa: Si el sustrato es glucosa, puede producir glucosa-1-fosfato
Estructura de las enzimas de quinasa y fosforilasa
Quinasa: La quinasa es una proteína de estructura terciaria muy compleja.
Fosforilasa: La forma biológicamente activa de la fosforilasa es un dímero de dos sub unidades de proteínas iguales. Por ejemplo, la glucógeno fosforilasa es una proteína enorme, contenida con 842 aminoácidos y masa de 97.434 KDA. El dímero de fosforilasa de glucógeno tiene varias secciones de importancia biológica, incluidos sitios catalíticos, sitios de unión a glucógeno y sitios alostéricos.
Regulación de la enzima quinasa y fosforilasa
Quinasa: La actividad de las quinasas está altamente regulada y tienen efectos intensos en una célula. Las quinasas se activan dentro o fuera de la fosforilación, mediante la unión del activador de proteínas o el inhibidor de la proteína o al gobernar su ubicación en la célula en relación con sus sustratos.
Fosforilasa: La fosforilasa de la glucógeno está regulada por el control alostérico y por la fosforilación. Las hormonas como la epinefrina y la insulina también pueden regular la fosforilasa de la glucógeno.
Clasificación de enzimas quinasa y fosforilasa
Quinasa: Las quinasas se clasifican en grupos integrales por el sustrato sobre el que actúan, como proteínas quinasas, quinasas lipídicas y quinasas de carbohidratos.
Fosforilasa: Las fosforilas clasificadas en dos; Glicosiltransferasas y nucleotidiltransferasas. Los ejemplos de glicosiltransferasas son,
- glucógeno fosforilasa
- fosforilasa de almidón
- maltodextrina fosforilasa
- Purina nucleósido fosforilasa
El ejemplo de nucleotidiltransferasas es,
- Polinucleótido fosforilasa
Patología de las enzimas de quinasa y fosforilasa
Quinasa: La actividad de la quinasa descontrolada puede causar cáncer y enfermedad en humanos, incluidos ciertos tipos de leucemia y muchos otros porque las quinasas regulan muchas fases que controlan el ciclo celular, incluidos el crecimiento, el movimiento y la muerte.
Fosforilasa: Algunas afecciones mediascales como la enfermedad de almacenamiento de glucógeno tipo V - Glucógeno muscular y enfermedad de almacenamiento de glucógeno tipo VI - glucógeno hepático, etc. están asociados con fosforilasas.
Referencias Chang. S., Rosenberg, M.J., Morton, H., Francomano, C.A. y Biesecker, L.GRAMO. (1998). Identificación de una mutación en la fosforilasa de glucógeno hepático en la enfermedad de almacenamiento de glucógeno tipo VI. Tararear. Moles. Gineta., 7(5): 865-70. Ciesla, J., Frączyk, t. y montó, w. (2011). Fosforilación de residuos de aminoácidos básicos en proteínas: importante pero fácil de perder. Acta biochimica polonica, 58(2): 137-147. Cazador, t. (1991). Clasificación de proteínas quinasa. Métodos en enzimología, 200: 3-37. Johnson, L. norte. (2009). La regulación de la fosforilación de proteínas. Bioquímico. Trans., 37(2): 627-641. Johnson, L. norte. y Barford, D. (1993). Los efectos de la fosforilación en la estructura y función de las proteínas. Revisión anual de biofísica y estructura biomolecular, 22(1): 199-232. Manning, G. Y Whyte, D. B. (2002). El complemento de la proteína quinasa del genoma humano. Ciencia, 298(5600): 1912-1934. Imagen cortesía: "Sitio activo de la dihidroxiacetona quinasa" por BDOC13 - Trabajo propio. (CC BY-SA 3.0) a través de Wikimedia Commons "Estructura cristalina 1e3p". (Dominio público) a través de Wikimedia Commons

