Diferencia entre el calor latente de la fusión y la vaporización
El diferencia clave entre el calor latente de la fusión y la vaporización es que El calor latente de la fusión es la cantidad de calor que requiere una sustancia sólida para cambiar su fase de fase sólida a fase líquida a una temperatura constante, mientras que el calor latente de vaporización es la cantidad de calor que una sustancia líquida requiere para cambiar su fase de la fase líquida a la fase de vapor a una temperatura constante.
El calor latente de fusión y vaporización se refiere al cambio en la energía térmica a temperaturas constantes. El calor latente de la fusión describe el cambio en el calor en el punto de fusión de una sustancia. Por el contrario, el calor latente de vaporización describe el cambio en el calor en el punto de ebullición de una sustancia. Del mismo modo, hay algunas diferencias entre los dos conceptos químicos.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el calor latente de la fusión?
3. ¿Qué es el calor latente de la vaporización?
4. Comparación de lado a lado: calor latente de fusión frente a vaporización en forma tabular
5. Resumen
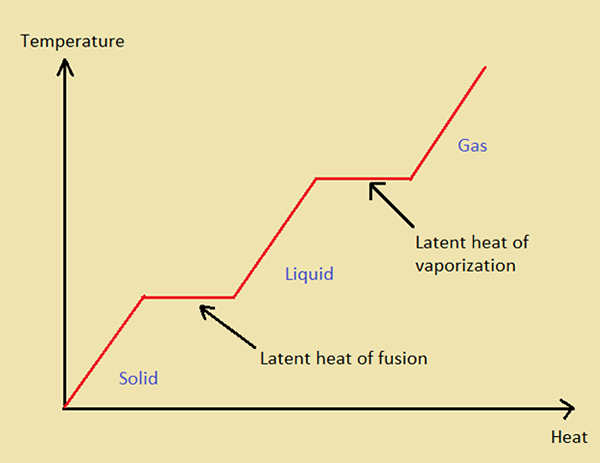
¿Qué es el calor latente de la fusión??
El calor latente de la fusión es la cantidad de calor que requiere una sustancia sólida para cambiar su fase de fase sólida a fase líquida a una temperatura constante, denotada por HF. En otras palabras, una masa unitaria de una sustancia requiere una energía térmica que sea igual al calor latente de fusión (de esa sustancia particular) en su punto de fusión, para convertirse en su fase líquida. La fusión se está derritiendo (licuar un sólido al proporcionar calor). Diferentes sustancias tienen diferentes puntos de fusión; Por lo tanto, diferentes valores para HF.
Ecuación del calor latente de la fusión
La ecuación para hF es como sigue:
HF = ΔQF/ m
Aquí, ΔQFes el cambio en la energía de la sustancia y M es la masa de la sustancia.
¿Qué es el calor latente de la vaporización??
El calor latente de la vaporización es la cantidad de calor que requiere una sustancia líquida para cambiar su fase de la fase líquida a la fase de vapor a una temperatura constante, denotada por HV. En otras palabras, una masa unitaria de una sustancia requiere una energía térmica que sea igual al calor latente de vaporización (de esa sustancia particular) en su punto de ebullición, para convertirse en su fase gaseosa.

Figura 01: Gráfico que indica el calor latente de la fusión y la vaporización
Ecuación del calor latente de vaporización
La ecuación para hV es como sigue:
HV = ΔQV/ m
Aquí ΔQV es el cambio en la energía de la sustancia y M es la masa de la sustancia.
¿Cuál es la diferencia entre el calor latente de la fusión y la vaporización??
El calor latente de la fusión es la cantidad de calor que requiere una sustancia sólida para cambiar su fase de fase sólida a fase líquida a una temperatura constante, mientras que el calor latente de vaporización es la cantidad de calor que una sustancia líquida requiere para cambiar su fase del líquido fase a fase de vapor a una temperatura constante.
El calor latente de la fusión se denota por hF mientras que el calor latente de vaporización se denota por HY . Con respecto a la temperatura constante, el calor latente de la fusión es el cambio de calor en el punto de fusión de una sustancia, mientras que el calor latente de vaporización se refiere al cambio de calor en el punto de ebullición de una sustancia.

Resumen -calor latente de fusión vs vaporización
El calor latente se refiere al cambio de calor a una temperatura constante. Diferentes sustancias tienen diferentes calores latentes en sus puntos de fusión y puntos de ebullición. La diferencia entre el calor latente de la fusión y la vaporización es que una sustancia cambia su fase de sólido a líquido cuando proporcionamos una cantidad de calor que es igual al calor latente de la fusión, mientras que una sustancia cambia su fase de líquido a vapor cuando proporcionamos un cantidad de calor que es igual al calor latente de vaporización.
Referencia:
1. "Calor latente." Ley de Ohm. Disponible aquí
2. "Estás siendo redirigido ..." Leyes de teorías de física Conceptos y recursos básicos con todas las ramas. Disponible aquí


