Diferencia entre la energía de la red y la energía de hidratación
Diferencia de clave: redes Energía Vs energía de hidratación
La energía de la red y la energía de hidratación son dos términos relacionados en termodinámica. La energía de la red es la cantidad de energía que se libera cuando se forma una red. La energía de hidratación es la energía que se libera cuando la red se disuelve en agua. Tanto la formación como la hidratación de una energía de liberación de celosía porque ambos procesos implican formación de enlaces químicos (o interacción química). El diferencia clave entre la energía de la red y la energía de hidratación es que La energía de la red es la cantidad de energía liberada cuando se forma un lunar de la red a partir de iones infinitamente separados, mientras que la energía de hidratación es la cantidad de energía liberada cuando una red se separa en iones por solvatación en agua.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la energía de la red?
3. ¿Qué es la energía de hidratación?
4. Relación entre la energía de la red y la energía de hidratación
5. Comparación lado a lado: energía de red versus energía de hidratación en forma tabular
6. Resumen
¿Qué es la energía de la red??
La energía de la red es una medida de la energía contenida en la red de cristal de un compuesto, que es igual a la energía que se liberaría si los iones componentes se unieran de la infinidad. En otras palabras, la energía de la red es la energía requerida en la formación de un cristal de iones completamente separados. Es muy difícil medir la energía de la red experimentalmente. Por lo tanto, se deriva teóricamente.
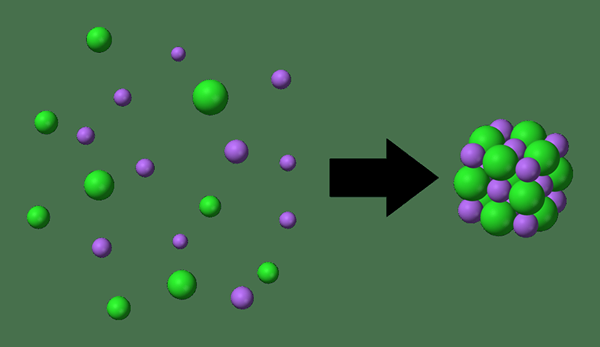
Figura 01: energía de la red
El valor de la energía de la red es siempre un valor negativo. Esto se debe a que la formación de red implica la formación de enlaces químicos. La formación de enlaces químicos son reacciones químicas exotérmicas, que liberan energía. El valor teórico para la energía de la red se determina de la siguiente manera.
ΔGRAMOU = δGRAMOH- P.ΔVmetro
En el que δGRAMOU es la energía de la red molar, δGRAMOH Molar Rediche Entalpía y ΔVmetro es el cambio de volumen por lunar. P es la presión externa. Por lo tanto, la energía de la red también se puede definir como el trabajo que debe hacerse contra la presión externa, P.
¿Qué es la energía de hidratación??
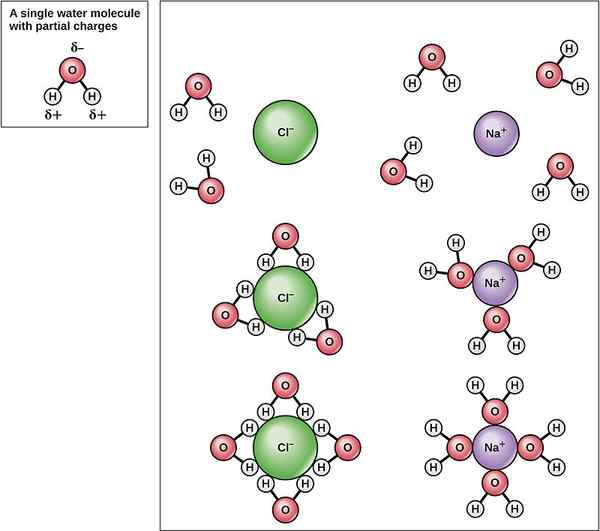
La energía de hidratación (o entalpía de hidratación) es la cantidad de energía liberada cuando un mol de iones sufre hidratación. La hidratación es un tipo especial de disolución de iones en el agua. Los iones pueden ser cargados positivamente o especies químicas cargadas negativamente. Cuando un compuesto iónico sólido se disuelve en agua, los iones más externos de ese sólido se alejan del sólido y se disuelven en agua. Allí, los iones liberados están cubiertos con moléculas de agua vecinas.
La hidratación de un compuesto iónico incluye interacciones intramoleculares. Estas son interacciones iónicas-dipolo. La entalpía de la hidratación o la energía de hidratación es la energía que se libera cuando los iones se disuelven en agua. La hidratación es, por lo tanto, una reacción exotérmica. Esto se debe a que la disolución de iones crea interacciones entre iones y moléculas de agua. La formación de interacciones libera energía porque la hidratación estabiliza los iones en una solución acuosa.

Figura 02: Hidratación de Na+ y Cl-iones
La energía de hidratación se denota como Hhilera. Cuando se consideran las energías de hidratación de diferentes iones, el valor de la energía de hidratación disminuye con el aumento del tamaño iónico. Esto se debe a que, cuando aumenta el tamaño iónico, la densidad electrónica del ion disminuye. Entonces la interacción entre las moléculas de iones y agua también disminuye, lo que resulta en una disminución de la energía de hidratación.
¿Cuál es la relación entre la energía de la red y la energía de hidratación??
- La energía de la disolución es igual a la suma de la energía de la red y la energía de hidratación. Esto se debe a que, para disolver una red en el agua, la red debe sufrir disociación e hidratación. La red debe tener una cantidad de energía que pueda disociar la red en iones. Esto es igual a la energía de la red.
¿Cuál es la diferencia entre la energía de la red y la energía de hidratación??
Energía de red vs energía de hidratación | |
| La energía de la red es una medida de la energía contenida en la red de cristal de un compuesto, igual a la energía que se liberaría si los iones componentes se unieran desde el infinito. | La hidratación (o la entalpía de la hidratación) es la cantidad de energía liberada cuando un mol de iones experimenta hidratación. |
| Energía | |
| La energía de la red es la cantidad de energía liberada cuando se forma un lunar de la red a partir de iones infinitamente separados. | La energía de hidratación es la cantidad de energía liberada cuando una red se separa en iones por solvatación en agua. |
| Proceso | |
| La energía de la red se relaciona con la formación de una red. | La energía de hidratación se relaciona con la destrucción de una red. |
Resumen - Enrejado Energía Vs energía de hidratación
La energía de la red se relaciona con la formación de una red, mientras que la energía de hidratación se relaciona con la destrucción de una red. La diferencia entre la energía de la red y la energía de hidratación es que la energía de la red es la cantidad de energía liberada cuando un mol de la red se forma a partir de iones infinitamente separados, mientras que la energía de hidratación es la cantidad de energía liberada cuando una red se separa en iones por solvatación en agua.
Referencia:
1."Energía reticular."Wikipedia, Fundación Wikimedia, 28 de febrero. 2018. Disponible aquí
2."Energía de la red: el ciclo de nacimiento nacido."Bibliotecas de química, Librettexts, 15 de febrero. 2017. Disponible aquí
Imagen de cortesía:
1.'Latte-Denthalpy-NaCl-3D-ionic'by Benjah-BMM27-Trabajo propio, (dominio público) a través de Commons Wikimedia
2.'OSC Microbio 00 AA Hydration'by CNX OpenStax (CC por 4.0) a través de Commons Wikimedia


