Diferencia entre la ley de composición constante y la ley de múltiples proporciones
El diferencia clave entre la ley de composición constante y ley de múltiples proporciones es que Según la ley de composición constante, la misma proporción de muestras siempre consiste en la misma proporción de elementos por masa, mientras que según la ley de proporciones múltiples, si dos elementos se unen entre sí formando más de un compuesto químico, entonces la relación Entre las masas del segundo elemento que se combina con una masa fija del primer elemento tiene relaciones de pequeños números enteros.
La ley de las composiciones constantes y la ley de múltiples proporciones son teorías en química física que se utilizan para explicar la estequiometría en la química. La estequiometría es la medida de las cantidades relativas de reactivos y productos en una reacción química.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la ley de composición constante?
3. ¿Qué es la ley de múltiples proporciones?
4. Comparación de lado a lado - Ley de composición constante frente a la ley de proporciones múltiples en forma tabular
5. Resumen
¿Qué es la ley de composición constante??
La ley de la composición constante estados muestras de un compuesto siempre contendrán la misma proporción de elementos por masa. Podemos nombrar esta ley como la ley de proporciones definidas también. Esta ley describe que un compuesto dado siempre contendrá los mismos elementos en las mismas proporciones por masa.
Por ejemplo, ya sea agua del grifo o agua de mar, una molécula de agua siempre contendrá elementos de hidrógeno y oxígeno en las siguientes proporciones. La fórmula química de una molécula de agua es H2O, y la masa molar de esta molécula es de 18 g/moles. Por lo tanto, un mol de agua contiene 18 g de H2O. La relación entre H y O en la molécula de agua es 2: 1. En consecuencia, la fracción de masa de hidrógeno en agua = (2g / 18g) x 100% = 11.11% y la fracción de masa de oxígeno = (16g/18g) x 100% = 88.89%. Estas fracciones son constantes y no alteran según la fuente del agua y el método de separación.
La ley de composición constante depende del hecho de que cualquier átomo del mismo elemento (átomos que tiene el mismo número atómico) es similar entre sí. Teniendo en cuenta el ejemplo anterior, la suposición es que cualquier átomo de hidrógeno es similar a otro átomo de hidrógeno y viceversa. Pero también puede haber algunas excepciones. mi.gramo. La composición isotópica de un elemento puede variar según la fuente. Por lo tanto, la estequiometría muestra variaciones dependiendo de la fuente de elementos.
¿Qué es la ley de múltiples proporciones??
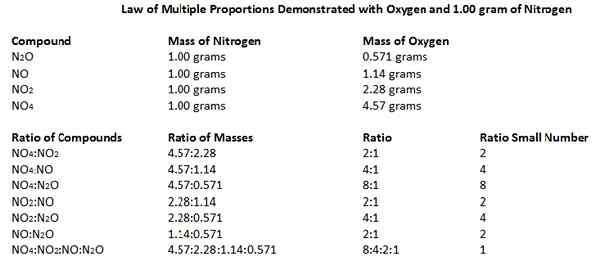
La ley de múltiples proporciones establece que cuando dos elementos se combinan entre sí para formar más de un compuesto, los pesos de un elemento que se combinan con un peso fijo del otro están en una relación de pequeños números enteros.

Podemos llamar a esta ley también la ley de Dalton porque la ley fue desarrollada por John Dalton en 1803. Entendamos esta ley usando un ejemplo.
Los óxidos de nitrógeno consisten en átomos de nitrógeno y oxígeno. Podemos identificar cinco óxidos diferentes de nitrógeno que existen: n2O, no, n2O3, NO2 y N2O5. Teniendo en cuenta las relaciones de masa de N y O en estos compuestos de óxido, 14 gramos de átomo de nitrógeno se combinan con 8, 16, 24, 32 y 40 gramos de oxígeno según la relación de masa, respectivamente. Si tomamos estos números como pequeños, números enteros, entonces las proporciones se pueden dar como 1: 1, 1: 2, 1: 3, 1: 4 y 1: 5.
¿Cuál es la diferencia entre la ley de composición constante y la ley de múltiples proporciones??
Según la ley de composición constante, la misma proporción de muestras siempre consiste en la misma proporción de elementos por masa, mientras que según la ley de proporciones múltiples, si dos elementos se unen entre sí formando más de un compuestos químicos, entonces la relación Entre las masas del segundo elemento que se combina con una masa fija del primer elemento tiene relaciones de pequeños números enteros. Entonces, esta es la diferencia clave entre la ley de composición constante y la ley de proporciones múltiples.

Resumen -Ley de composición constante frente a la ley de proporciones múltiples
Según la ley de composición constante, la misma proporción de muestras siempre consiste en la misma proporción de elementos por masa, mientras que según la ley de proporciones múltiples, si dos elementos se unen entre sí formando más de un compuestos químicos, entonces la relación Entre las masas del segundo elemento que se combina con una masa fija del primer elemento tiene relaciones de pequeños números enteros. Por lo tanto, esta es la diferencia entre la ley de composición constante y la ley de múltiples proporciones.
Referencia:
1. Helmenstine, Anne Marie. "Ley de composición constante en química."Thinkco, agosto. 26, 2020, disponible aquí.
Imagen de cortesía:
1. "Demostración de la ley de múltiples proporciones" por Kenji Agari - Trabajo propio (CC By -SA 3.0) a través de Commons Wikimedia


