Diferencia entre las moléculas lineales y dobladas
El diferencia clave entre las moléculas lineales y dobladas es que Las moléculas lineales tienen átomos unidos entre sí, formando una molécula recta, mientras que las moléculas dobladas tienen átomos dispuestos en forma de curva con un ángulo.
Los términos moléculas lineales y moléculas dobladas describen las formas de diferentes moléculas. Podemos clasificar diferentes compuestos químicos en diferentes grupos dependiendo de la forma de la molécula; lineal, angular/doblado, plano, piramidal, etc. Las formas lineales y dobladas son las más simples entre ellas.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son las moléculas lineales?
3. ¿Qué son las moléculas dobladas?
4. Comparación lado a lado: moléculas lineales vs dobladas en forma tabular
5. Resumen
¿Qué son las moléculas lineales??
Las moléculas lineales son moléculas rectas que tienen un ángulo de enlace de 180 grados. Básicamente, estas moléculas contienen un átomo central unido a otros dos átomos a través de enlaces individuales o dobles (a veces también puede haber triples enlaces). La polaridad de este tipo de moléculas es cero si los dos átomos unidos son idénticos. Sin embargo, si hay dos átomos diferentes unidos a un átomo central que forma una molécula lineal, forma un compuesto polar. El número de coordinación del átomo central es dos porque tiene dos átomos unidos.
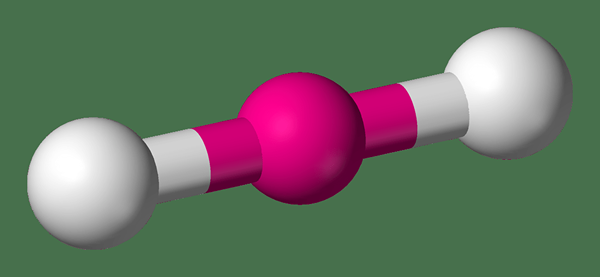
Figura 01: forma de una molécula lineal
Además, el átomo central generalmente no tiene pares de electrones solitarios o tres pares de electrones solitarios. Algunos ejemplos comunes de moléculas lineales incluyen dióxido de carbono (el átomo central es de carbono y dos átomos de oxígeno se unen al átomo de carbono a través de enlaces dobles que forman un compuesto no polar), acetileno (contiene un resto de carbono triple unido a dos átomos de hidrógeno a través de un solo compuesto Formando una molécula lineal), el cianuro de hidrógeno (contiene un átomo de carbono central unido a un átomo de hidrógeno a través de un solo enlace y a un átomo de nitrógeno a través de un enlace triple), etc.
¿Qué son las moléculas dobladas??
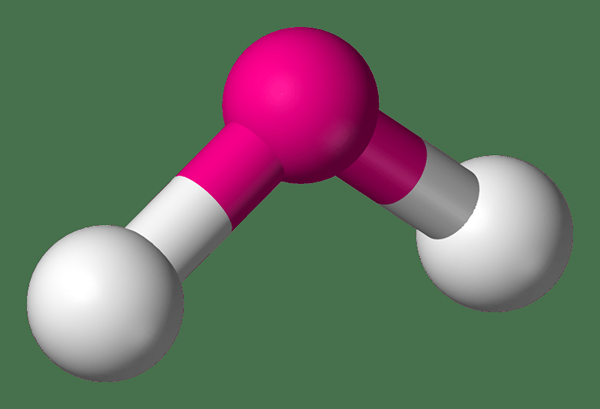
Las moléculas dobladas son moléculas angulares que tienen un ángulo de enlace que es inferior a 180 grados. Esto significa que estas moléculas son moléculas no lineales. La mayoría de las veces, algunos átomos como el oxígeno forman moléculas dobladas debido a su configuración de electrones. El ángulo de enlace de una molécula doblada está determinado por la electronegatividad de cada átomo en la molécula, lo que provoca las repulsiones o atracciones entre los átomos.

Figura 02: Forma de una molécula doblada
Comúnmente podemos observar una disposición no lineal de las moléculas en moléculas y iones triatómicos que contienen solo elementos grupales principales. La estructura doblada de estas moléculas es el resultado de la presencia de pares de electrones solitarios en el átomo central. Los ejemplos más comunes de moléculas dobladas incluyen agua, dióxido de nitrógeno, CH2, etc.
¿Cuál es la diferencia entre moléculas lineales y dobladas??
La diferencia clave entre las moléculas lineales y dobladas es que las moléculas lineales tienen átomos unidos entre sí, formando una molécula recta, mientras que las moléculas dobladas tienen los átomos dispuestos en forma de curva con un ángulo. Además, las moléculas lineales son moléculas rectas que tienen un ángulo de enlace de 180 grados, mientras que las moléculas dobladas son moléculas angulares que tienen un ángulo de enlace que está por debajo de 180 grados.
La siguiente infografía resume la diferencia entre las moléculas lineales y dobladas.

Resumen -Moléculas lineales vs dobladas
La forma o la geometría de diferentes moléculas se pueden usar para clasificar las moléculas en diferentes grupos. Las moléculas lineales y dobladas son dos grupos de moléculas de este tipo. La diferencia clave entre las moléculas lineales y dobladas es que las moléculas lineales tienen los átomos unidos entre sí, formando una molécula recta, mientras que las moléculas dobladas tienen los átomos dispuestos en forma de curva con un ángulo.
Referencia:
1. "Geometría molecular doblada."Wikipedia.org, 30 de mayo de 2020, disponible aquí.
Imagen de cortesía:
1. "Linear-3D-Balls" (dominio público) a través de Commons Wikimedia
2. "Ball-3D-Balls" (dominio público) a través de Commons Wikimedia


