Diferencia entre la serie Lyman y Balmer
El diferencia clave Entre la serie Lyman y Balmer está que La serie Lyman se forma cuando un electrón excitado alcanza el nivel de energía N = 1, mientras que la serie Balmer se forma cuando un electrón excitado alcanza el nivel de energía N = 2.
La serie Lyman y la serie Balmer llevan el nombre de los científicos que los encontraron. El físico Theodore Lyman descubrió la serie Lyman, mientras que Johann Balmer descubrió la serie Balmer. Estos son tipos de líneas espectrales de hidrógeno. Estas dos series de línea surgen de los espectros de emisión del átomo de hidrógeno.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la serie Lyman?
3. ¿Qué es la serie Balmer?
4. Comparación de lado a lado - Serie Lyman vs Balmer en forma tabular
5. Resumen
¿Qué es la serie Lyman??
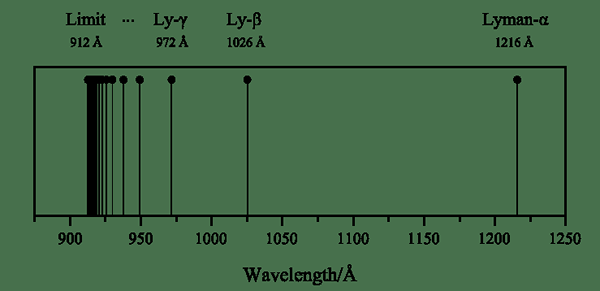
La serie Lyman es una serie de línea espectral de hidrógeno que se forma cuando un electrón excitado llega al nivel de energía N = 1. Y, este nivel de energía es el nivel de energía más bajo del átomo de hidrógeno. La formación de esta serie de línea se debe a las líneas de emisión ultravioleta del átomo de hidrógeno.

Figura 01: Serie Lyman
Además, podemos nombrar cada transición usando letras griegas; La transición de un electrón excitado de n = 2 a n = 1 es la línea espectral de Lyman alfa, de n = 3 a n = 1 es lyman beta, y así sucesivamente. El físico Theodore Lyman encontró la serie Lyman en 1906.
¿Qué es la serie Balmer??
La serie Balmer es una serie de línea espectral de hidrógeno que se forma cuando un electrón excitado llega al nivel de energía N = 2. Además, esta serie muestra las líneas espectrales para las emisiones del átomo de hidrógeno, y tiene varias líneas de balmor ultravioleta prominentes que tienen longitudes de onda que son más cortas que 400 nm.

Figura 02: Serie Balmer
La serie Balmer se calcula utilizando la fórmula Balmer, que es una ecuación empírica descubierta por Johann Balmer en 1885.
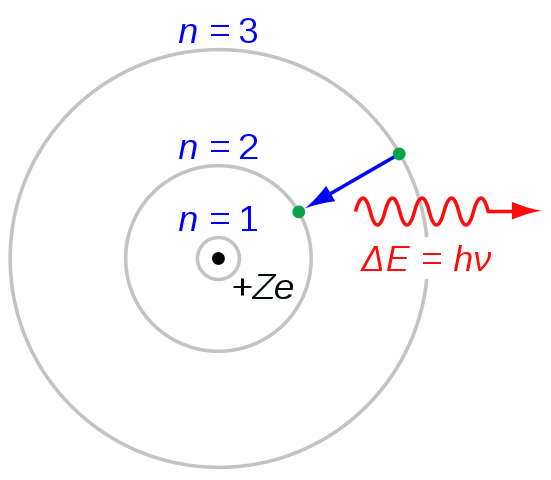
Figura 03: Transición de electrones para la formación de la serie Balmer
Al nombrar cada línea de la serie, usamos la letra "H" con letras griegas. Por ejemplo, de n = 3 a n = 2 la transición da lugar a la línea H-alfa, de n = 4 a n = 2 da lugar a la línea H-beta y así sucesivamente. La letra "H" significa "Hidrógeno". Al considerar las longitudes de onda, la primera línea espectral está en el rango visible del espectro electromagnético. Y esta primera línea tiene un color rojo brillante.
¿Cuál es la diferencia entre la serie Lyman y Balmer??
La serie Lyman y Balmer son series de línea espectral de hidrógeno que surgen de los espectros de emisión de hidrógeno. La diferencia clave entre la serie Lyman y Balmer es que la serie Lyman se forma cuando un electrón excitado alcanza el nivel de energía N = 1, mientras que la serie Balmer se forma cuando un electrón excitado alcanza el nivel de energía N = 2. Algunas líneas de series de culpa están en el rango visible del espectro electromagnético. Pero, la serie Lyman está en el rango de longitud de onda UV.
La serie Lyman y la serie Balmer llevan el nombre de los científicos que los encontraron. El físico Theodore Lyman encontró la serie Lyman, mientras que Johann Balmer encontró la serie Balmer. Al nombrar las líneas de los espectros, usamos una letra griega. Para las líneas en la serie Lyman, los nombres son como Lyman Alpha, Lyman Beta, etc., mientras que para las líneas en la serie Balmer los nombres son como H-alfa, H-beta, etc.
A continuación, la infografía resume la diferencia entre la serie Lyman y Balmer.

Resumen -Serie Lyman vs Balmer
Las series de Lyman y Balmer son series de línea espectral de hidrógeno que surge de los espectros de emisión de hidrógeno. La diferencia clave entre la serie Lyman y Balmer es que la serie Lyman se forma cuando un electrón excitado alcanza el nivel de energía N = 1, mientras que la serie Balmer se forma cuando un electrón excitado alcanza el nivel de energía N = 2. El físico Theodore Lyman descubrió la serie Lyman, mientras que Johann Balmer descubrió la serie Balmer.
Referencia:
1. "Serie Balmer."Wikipedia, Fundación Wikimedia, 21 de octubre. 2019, disponible aquí.
2. "Serie Lyman."Wikipedia, Fundación Wikimedia, 7 de octubre. 2019, disponible aquí.
Imagen de cortesía:
1. "Lymanseries" de Lymanseries1.GIF: el cargador original fue Adriferr en EN.Wikipediaderivative Trabajo: Orangedog (charla • Contribs) - Lymanseries1.gifvectorizado del original. La precisión también se redujo a estar de acuerdo con la mayoría de las fuentes., (CC BY-SA 3.0) a través de Commons Wikimedia
2. "Visible Spectrum of Hydrogen" por Jan Homann - Trabajo propio (CC BY -SA 3.0) a través de Commons Wikimedia
3. "Modelo Bohr Atom" de Jabberwok (CC BY-SA 3.0) a través de Commons Wikimedia


