Diferencia entre lisina y l-lisina
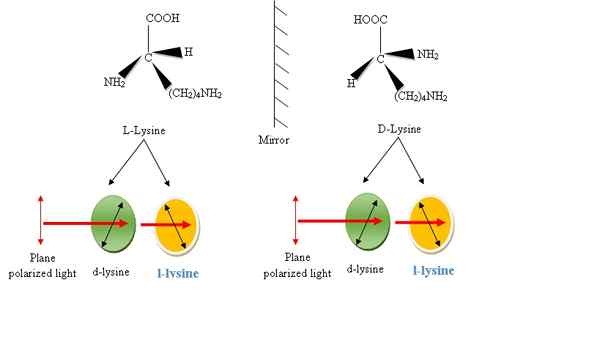
Diferencia clave: lisina vs l -lysine
Lysine y L-lysine son ambos tipos de aminoácidos, sin embargo, comparten las mismas propiedades físicas, hay alguna diferencia entre ellos. El La diferencia clave entre lisina y l-lisina es la capacidad de rotar la luz polarizada del plano. La lisina es un α-aminoácido esencial biológicamente activo que ocurre naturalmente. Puede ocurrir en dos formas isoméricas debido a la posibilidad de formar dos enantiómeros diferentes alrededor del átomo de carbono quiral. Estos se conocen como formularios L y D, análogos a las configuraciones zurdas y diestras. Se dice que estas formas L y D son ópticamente activas y giran la luz polarizada del plano en un sentido diferente; en sentido horario o antihorario. Si la luz gira lisina en sentido antihorario, entonces la luz exhibe levorotación y se conoce como l-lisina. Sin embargo, se debe tener en cuenta cuidadosamente que el etiquetado D y L de los isómeros no es el mismo que el etiquetado D y L.
Que es lisina?
Lysine es un Aminoácido esencial cual es no sintetizado en nuestro cuerpo y tiene que ser suministrado por la dieta regular. Por lo tanto, la lisina es un aminoácido esencial para los humanos. Es un compuesto orgánico biológicamente importante compuesto de amina (-nh2) y grupos funcionales de ácido carboxílico (-cooh) con fórmula química NH2-(CH2)4-CH (NH2) -Cooh. Los elementos clave de la lisina son el carbono, el hidrógeno, el oxígeno y el nitrógeno. En bioquímica, los aminoácidos que tienen la amina y los grupos de ácido carboxílico unidos al primer átomo de carbono (alfa) se conocen como α-aminoácidos. Por lo tanto, la lisina también se considera como α-aminoácidos. La estructura de la lisina se da en la Figura 1.
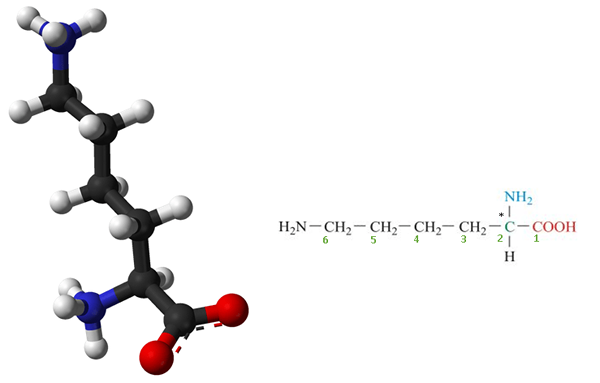
Figura 1: Estructura molecular de la lisina (* El átomo de carbono es un átomo de carbono quiral o asimétrico y también representa el átomo de carbono alfa)
La lisina es de naturaleza básica porque contiene dos grupos amino básicos y un grupo ácido de ácido carboxílico. Por lo tanto, también forma unión de hidrógeno extensa debido a la presencia de dos grupos amino. Buenas fuentes de lisina son fuentes animales ricas en proteínas como huevos, carne roja, cordero, carne de cerdo y aves de corral, queso y ciertos pescado (como bacalao y sardinas). Lysine también es rico en proteínas vegetales como soya, frijoles y guisantes. Sin embargo, es un aminoácido limitante en la mayoría de los granos de cereales, pero es abundante en la mayoría de las legumbres y legumbres.
Que es l-lysine?
Lysine tiene cuatro grupos diferentes alrededor de los 2Dakota del Norte carbono, y es estructura asimétrica. Además, la lisina es un aminoácido ópticamente activo debido a la presencia de este átomo de carbono asimétrico o quiral. Por lo tanto, la lisina puede crear estereoisómeros que son moléculas isoméricas que tienen la misma fórmula molecular, pero difieren en las orientaciones tridimensionales de sus átomos en el espacio. Los enantiómeros son dos estereoisómeros que están relacionados entre sí por un reflejo o son imágenes espejo entre sí que no son superpuestas. La lisina está disponible en dos formas enantioméricas conocidas como L y D y los enantiómeros de la lisina se dan en la Figura 2.

Figura 2: Enantiómeros de aminoácido lisina. Los grupos COOH, H, R y NH2 están dispuestos alrededor del átomo de C de una manera en el sentido de las agujas del reloj, el enantiómero se llama L-forma y Form de otra manera. L- y D- Solo se refieren a la disposición espacial alrededor del átomo de carbono y no se refieren a la actividad óptica. Mientras que las formas L y D de una molécula quiral giran el plano de la luz polarizada en diferentes direcciones, algunas formas L (o Forms D) giran la luz a la izquierda (LEVO o L-Forma) y otras a la derecha a la derecha (dextro o forma d). Los formularios L y D se llaman isómeros ópticos.
La lisina y la D-lisina son enantiómeros entre sí, tienen las mismas propiedades físicas, excepto por la dirección en la que giran la luz polarizada. Tienen una relación de imagen de espejo no superposible. Sin embargo, la nomenclatura de D y L no es común en los aminoácidos, incluida la lisina. Gire la luz polarizada en plano en la misma magnitud pero en diferentes direcciones. El isómero D y L de lisina que gira la luz polarizada del plano en el sentido de las agujas del reloj se llama dextrorotatorio o D-lisina y el que gira la luz polarizada del plano en la dirección en sentido antihorario se llama laevorotatoria o L-lisina (Figura 2).
L-lysine es el La mayoría de la forma estable disponible de lisina. D-lisina es una forma sintética de lisina y se puede sintetizar a partir de l-lisina por racemización. Se utiliza en el procesamiento de poli-d-lysina, que se utiliza como material de recubrimiento para mejorar la unión celular. La l-lisina juega un papel importante en el cuerpo humano, en la absorción de calcio, el desarrollo de proteínas musculares y la síntesis de hormonas, enzimas y anticuerpos. Industrialmente, la l-lisina es producida por un proceso de fermentación microbiana utilizando Corynebacterium glutamicum.
¿Cuál es la diferencia entre lisina y l-lysine??
La lisina y la l-lisina tienen las mismas propiedades físicas, excepto por la dirección en la que giran la luz polarizada. Como resultado, la l-lisina puede tener efectos biológicos y propiedades funcionales sustancialmente diferentes. Sin embargo, se han realizado investigaciones muy limitadas para distinguir estos efectos biológicos y propiedades funcionales. Algunas de estas diferencias pueden incluir,
Gusto
L-lisina: Las formas L de aminoácidos tienden a ser insípidas.
D-lisina: Las formas d de aminoácidos tienden a tener un sabor dulce.
Por lo tanto, la l-lisina puede ser menos/no más dulce que la lisina.
Abundancia
L-lisina: Las formas L de aminoácidos, incluida la lisina, es la forma más abundante de la naturaleza. Como ejemplo, nueve de los diecinueve l-aminoácidos que se encuentran comúnmente en las proteínas son dextrorotatorios y el resto son levorotatorios.
D-lisina: Se encontró que las formas d de aminoácidos que se observaron experimentalmente ocurrían muy raramente.
Referencias: Solomons, T.W. Graham y Graig B. Fryhle (2004). Química orgánica (8th ed). Hoboken: John Wiley & Sons, Inc. Everhardus, un. (1984). Estereoquímica, una base para una tontería sofisticada en farmacocinética y farmacología clínica, Revista Europea de Farmacología Clínica, 26, 663-668. Cortesía de la imagen: "L-lysine-monocalización-de hidrocloruro-dihidrato-stal-3d-balls" por Ben Mills-Trabajo propio a través de Wikimedia Commons


