Diferencia entre el número cuántico magnético y el número cuántico de giro
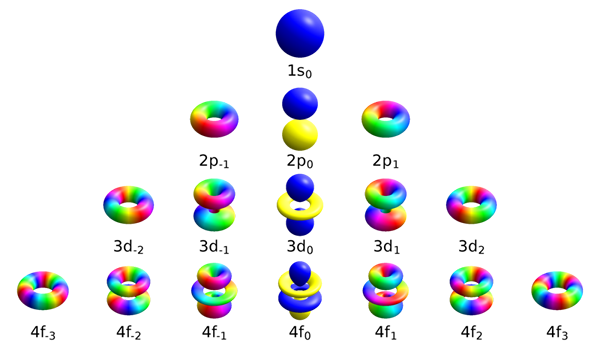
El diferencia clave Entre el número cuántico magnético y el número cuántico de giro es que El número cuántico magnético es útil para diferenciar los orbitales disponibles dentro de las subshells, mientras que el número cuántico de giro describe la energía, la forma y la orientación de un orbital.
Los números cuánticos son un conjunto de valores que describen el estado cuántico único de un electrón en un átomo. Hay cuatro números cuánticos específicos: número cuántico principal, número cuántico angular, número cuántico magnético y número cuántico giratorio.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el número cuántico magnético?
3. ¿Qué es el número cuántico de giro?
4. Comparación de lado a lado: número cuántico magnético frente al número cuántico de giro en forma tabular
5. Resumen
¿Qué es el número cuántico magnético??
El número cuántico magnético diferencia los orbitales disponibles dentro de las subshells. El símbolo de este valor es mi. Según su definición, este número cuántico establece que los electrones en cada subshell en particular tienen números cuánticos angulares que varían de -l a +L más cero. Por lo tanto, las subshells S, P, D y F contienen diferentes números de orbitales. La siguiente tabla muestra el número de orbitales presentes en cada subshell.
| Subshell | Valores para el número cuántico magnético | Número de orbitales |
| s | metroi= 0 | 1 |
| pag | metroi= -1,0,+1 | 3 |
| d | metroi= -2, -1,0,+1,+2 | 5 |
| F | metroi= -3, -2, -1,0,+1,+2,+3 | 7 |
El número cuántico magnético determina el cambio de energía de un orbital que ocurre debido al campo magnético aplicado externamente. Llamamos a este efecto el "efecto Zeeman". El momento magnético real surge de dos factores: momento angular de electrones y giro de electrones, que se describen a partir del número cuántico magnético.
¿Qué es el número cuántico de giro??
El número cuántico de giro describe la energía, la forma y la orientación de un orbital. El símbolo de este valor es "s". El número cuántico de giro es un parámetro del momento angular intrínseco de un átomo. El momento angular giratorio de un electrón en un orbital se da como S = 1/2.
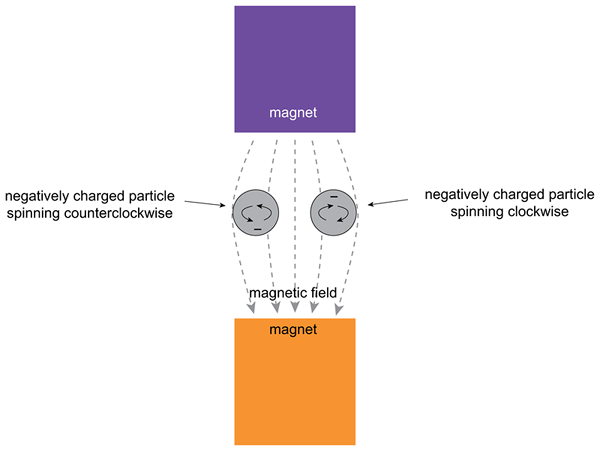
Figura 02: Efecto de un campo magnético externo en un electrón
Un orbital puede contener un par de electrones; Por lo tanto, los dos electrones tienen S = -1/2 y S =+1/2 Números cuánticos de giro. Se refiere a las orientaciones de "giración" y "giro" de los electrones. El número cuántico especifica el estado cuántico de un electrón particular de un átomo. Además, podemos dar un "Número Quantum de giro total" (s), que combina los giros de varios electrones no apareados de algunos átomos ciertos.
¿Cuál es la diferencia entre el número cuántico magnético y el número cuántico de giro??
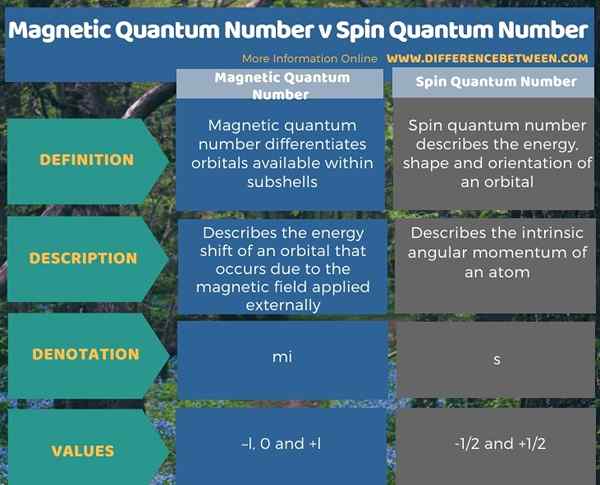
Los números cuánticos son un conjunto de valores que describen el estado cuántico único de un electrón en un átomo. La diferencia clave entre el número cuántico magnético y el número cuántico de giro es que el número cuántico magnético es útil para diferenciar los orbitales disponibles dentro de las subshells, mientras que el número cuántico de giro describe la energía, la forma y la orientación de un orbital. Los valores para el número cuántico magnético se dan como -l, 0 y +L. El símbolo de este valor es mi. Pero, el número cuántico de giro se da como -1/2 y +1/2. El símbolo de este valor es "s".
Además, una diferencia adicional entre el número cuántico magnético y el número cuántico de giro es que el número cuántico magnético describe el cambio de energía de un orbital que ocurre debido al campo magnético aplicado externamente, mientras que el número cuántico de giro describe el momento angular intrínseco de un átomo.
Resumen -Número cuántico magnético vs número cuántico de spin
Los números cuánticos son un conjunto de valores que describen el estado cuántico único de un electrón en un átomo. La diferencia clave entre el número cuántico magnético y el número cuántico de giro es que el número cuántico magnético es útil para diferenciar los orbitales disponibles dentro de las subshells, mientras que el número cuántico de giro describe la energía, la forma y la orientación de un orbital.
Referencia:
1. "Números cuánticos para átomos."Bibliotecas de química, Librettexts, 27 de septiembre. 2019, disponible aquí.
2. "Número cuántico magnético."Wikipedia, Fundación Wikimedia, 16 de noviembre. 2019, disponible aquí.
3. "Número cuántico de giro."Wikipedia, Fundación Wikimedia, 1 de septiembre. 2019, disponible aquí.
4. Helmenstine, Anne Marie. “Definición de número cuántico de giro."Thinkco, dec. 7, 2018, disponible aquí.
Imagen de cortesía:
1. "Orbitales atómicos SPDF M -Eigenstates" por Geek3 - Trabajo propio, creado con hidrógeno 1.1 (CC BY-SA 4.0) a través de Commons Wikimedia
2. "Dos partículas cargadas negativamente que giran en un campo magnético" por la Fundación CK -12 - Archivo: Química de la escuela secundaria.PDF, página 280 (CC BY-SA 3.0) a través de Commons Wikimedia


