Diferencia entre el punto de fusión y el punto de congelación

El diferencia clave entre el punto de fusión y el punto de congelación es que El punto de fusión es la temperatura a la que un sólido irá al estado líquido, mientras que el punto de congelación es el punto en el que cualquier líquido cambiará su estado a un sólido.
Los cambios de fase son procesos que involucran la liberación de energía o ganancia de energía. El punto de fusión y el punto de congelación son puntos en los que ocurren cambios de fase. Con estos, muchas otras propiedades del material también pueden cambiar. Teóricamente, el punto de congelación y el punto de fusión de un material son los mismos, pero a veces para sustancias particulares, los dos valores difieren entre sí.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es el punto de fusión
3. ¿Qué es el punto de congelación?
4. Comparación de lado a lado: punto de fusión frente al punto de congelación en forma tabular
5. Resumen
Que es el punto de fusión?
El punto de fusión es la temperatura a la que un sólido se cambiará a su estado líquido. Es una propiedad física que podemos usar para identificar un compuesto. Cuando un sólido se convierte en una etapa líquida, se produce un cambio de fase. Ocurre a una temperatura característica para una presión dada. Para esto, necesitamos suministrar la energía requerida.
El cambio de fase absorbe energía/ calor (endotérmico) cuando va de sólido a líquido. La mayoría de las veces, esta energía se suministra en forma de calor. Se requiere calor para aumentar la temperatura del sólido a su estado de fusión. Además, la sustancia necesita la energía para derretirse. Llamamos a este calor de la fusión energética; Este es un tipo de calor latente.
El calor latente es el calor que se absorbe o libera de una sustancia durante un cambio de fase. Estos cambios de calor no causan cambios de temperatura a medida que se absorben o liberan. Por lo tanto, en el punto de fusión, la sustancia absorbe el calor, pero la temperatura no cambiará en consecuencia. Termodinámicamente, en el punto de fusión, el cambio de energía libre de Gibbs es cero. La siguiente ecuación es válida para un material en el punto de fusión. Muestra que la temperatura no cambia, sino la entalpía y la entropía del cambio de material.
ΔS = ΔH/T
Dado que la sustancia absorbe energía, la entalpía aumenta en el punto de fusión. En estado sólido, las partículas están bien ordenadas y tienen menos movimiento. Pero en el estado líquido, su naturaleza aleatoria aumenta. Por lo tanto, en el punto de fusión, la entropía aumenta. Según la presión, hay un punto de fusión específico para un material dado. Solo podemos determinar los puntos de fusión para los sólidos.
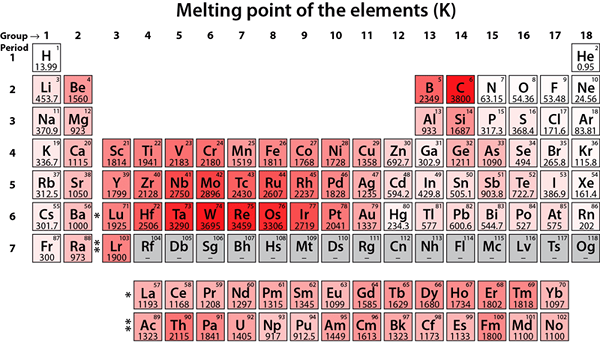
Figura 01: Puntos de fusión de diferentes elementos químicos
En el laboratorio, podemos usar muchas técnicas para determinar el punto de fusión. Usar un aparato de punto de fusión es muy fácil. Podemos poner un poco de sólido finamente en polvo en un capilar en el que se selle un extremo. Entonces debemos poner el extremo sellado que contiene el sólido en el aparato. Aquí, el final debe tocar el metal en el interior. A partir de entonces, podemos observar el sólido a través de la ventana de lupa del aparato. También hay un termómetro para registrar la temperatura. Cuando la temperatura aumenta gradualmente, el metal se calentará y el sólido en el capilar también se calentará. Podemos observar el punto en el que comienza y termina la fusión. Y, este rango corresponde al punto de fusión. El punto de fusión del agua es 0 ° C. El tungsteno tiene el punto de fusión más alto, que es 3410 ° C.
¿Qué es el punto de congelación??
El punto de congelación es la temperatura a la que cualquier líquido cambiará su estado a un sólido. La temperatura del punto de fusión y el punto de congelación para un material es más o menos el mismo valor. Por ejemplo, el agua se convierte en hielo a 0 ° C y su punto de fusión también es de 0 ° C. Más precisamente, el punto de congelación describe el cambio de fase de la materia.

Figura 02: congelar a las formas de agua hielo
Además, el proceso de congelar una sustancia disminuye la entropía. Hay un término en química como "depresión del punto de congelación" que explica cómo la presencia de un soluto no volátil en una solución disminuye la temperatura de congelación del solvente.
¿Cuál es la diferencia entre el punto de fusión y el punto de congelación??
El punto de fusión y el punto de congelación son direcciones opuestas del mismo cambio de fase. La diferencia clave entre el punto de fusión y el punto de congelación es que el punto de fusión es la temperatura a la que un sólido irá al estado líquido, mientras que el punto de congelación es el punto en el que cualquier líquido cambiará su estado a un sólido. Además, también hay una diferencia entre el punto de fusión y el punto de congelación en términos de su cambio de entropía; Mientras se derrite un sólido, la entropía aumenta, pero en la congelación, la entropía disminuye. Además, aunque teóricamente, el punto de fusión y las temperaturas del punto de congelación son similares para un material dado, prácticamente varían ligeramente.
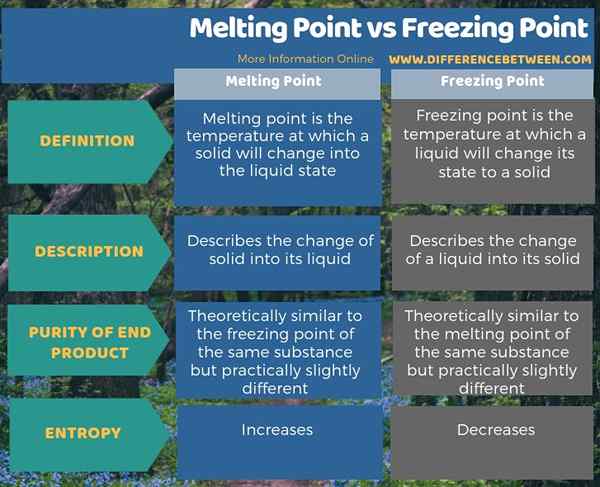
Resumen -Punto de fusión vs Punto de congelación
El punto de fusión y el punto de congelación son dos propiedades físicas de las sustancias. La diferencia clave entre el punto de fusión y el punto de congelación es que el punto de fusión es la temperatura a la que un sólido irá al estado líquido, mientras que el punto de congelación es el punto en el que cualquier líquido cambiará su estado a un sólido.
Referencia:
1. Helmenstine, Anne Marie, PH.D. "¿Cuál es el punto de congelación del agua??"Thinkco, octubre. 5, 2018, disponible aquí.
Imagen de cortesía:
1. "Punto de fusión de los elementos (k)" por Albris - Trabajo propio (CC BY -SA 4.0) a través de Commons Wikimedia
2. "1550739" (CC0) a través de pxhere


