Diferencia entre metátesis y reacciones redox
El diferencia clave entre la metátesis y las reacciones redox es que En las reacciones de metátesis, se produce el intercambio de dos especies iónicas entre dos moléculas, mientras que, en reacciones redox, se produce el intercambio de electrones entre dos especies químicas.
Las reacciones de metátesis y redox son dos tipos de reacciones químicas. Pero tienen diferentes mecanismos de acción. La metátesis es una reacción de un solo paso, mientras que una reacción redox tiene dos medias reacciones paralelas necesarias para el proceso de intercambio de electrones.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la metátesis?
3. ¿Qué son las reacciones redox?
4. Similitudes entre metátesis y reacciones redox
5. Comparación de lado a lado -Reacciones de metátesis vs redox en forma tabular
6. Resumen
¿Qué es la metátesis??
Las reacciones de metátesis o doble desplazamiento son un tipo de reacción química en la que se produce un intercambio de dos especies iónicas entre dos moléculas. La fórmula general es la siguiente:
A-B+C-D ⟶ A-C+B-D
El enlace que se rompe y se forma durante esta reacción puede ser enlaces iónicos o covalentes. Algunos ejemplos de este tipo de reacción incluyen reacciones de precipitación, reacciones ácido-base, alquilación, etc.
En la ecuación anterior, los componentes A y C de cada reactivo han cambiado sus lugares. En general, estas reacciones ocurren en soluciones acuosas. Además, podemos clasificar estas reacciones de la siguiente manera;
- Reacciones de precipitación: un precipitado se forma al final de la reacción. Por ejemplo, la reacción entre el nitrato de plata y el cloruro de sodio forma precipitado por cloruro de plata y nitrato de sodio acuoso.
- Reacciones de neutralización: un ácido se neutraliza en la reacción con una base. Por ejemplo, una solución de HCl (ácido) se puede neutralizar a partir de una solución de NaOH (base).

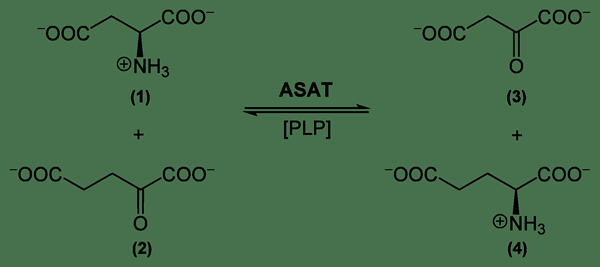
Figura 01: Un ejemplo de una reacción de doble desplazamiento
¿Qué es la reacción redox??
La reacción redox es un tipo de reacción química en la que se producen medias reacciones de oxidación y reducción simultáneamente. En esta reacción, consideramos la oxidación y la reducción como procesos complementarios. Aquí, la oxidación es la pérdida de electrones o el aumento en el estado de oxidación, mientras que la reducción es la ganancia de electrones o disminución del estado de oxidación.
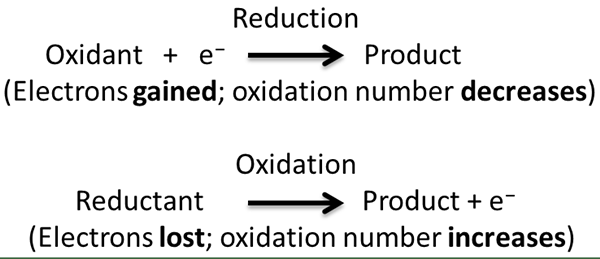
Figura 02: Mecanismo para reacciones de oxidación y reducción
Además, la velocidad de una reacción redox puede variar de procesos muy lentos, como la oxidación hasta procesos rápidos como la quema de combustible.
¿Cuáles son las similitudes entre la metátesis y las reacciones redox??
- Las reacciones de metátesis y redox son reacciones químicas en las que los productos son completamente diferentes de los reactivos.
- Ambas reacciones implican el intercambio de algo entre los reactivos para dar el producto (s). mi.G intercambio de electrones, restos químicos.
- Estas reacciones involucran dos reacciones complementarias. mi.gramo. Reacciones de oxidación-reducción en reacciones redox, reacciones de formación de enlaces de enlace en reacciones de metátesis.
¿Cuál es la diferencia entre la metátesis y las reacciones redox??
Las reacciones de metátesis y redox son dos tipos de reacciones químicas. La diferencia clave entre la metátesis y las reacciones redox es que en las reacciones de metátesis, se produce el intercambio de dos especies iónicas entre dos moléculas, mientras que, en las reacciones redox, se produce el intercambio de electrones entre dos especies químicas. Una reacción o metátesis de doble desplazamiento es una reacción de un solo paso, pero una reacción redox tiene dos medias reacciones paralelas necesarias para el proceso de intercambio de electrones. Además, los estados de oxidación de los átomos cambian necesariamente durante una reacción redox pero, en las reacciones de metátesis, puede o no cambiar.
A continuación, la infografía resume la diferencia entre la metátesis y las reacciones redox.

Resumen -Reacciones de metátesis vs redox
Las reacciones de metátesis y redox son dos tipos de reacciones químicas. La diferencia clave entre la metátesis y las reacciones redox es que en las reacciones de metátesis, se produce el intercambio de dos especies iónicas entre dos moléculas, mientras que, en las reacciones redox, se produce el intercambio de electrones entre dos especies químicas. Además, la metátesis es una reacción de un solo paso, mientras que una reacción redox tiene dos medias reacciones paralelas necesarias para el proceso de intercambio de electrones.
Referencia:
1. "Reacciones de metátesis."Bibliotecas de química, Librettexts, 5 de junio de 2019, disponible aquí.
2. "Reacciones de reducción de oxidación."Bibliotecas de química, Librettexts, 5 de junio de 2019, disponible aquí.
Imagen de cortesía:
1. "Reacción de transaminasa de aspartato" por Yikrazuul - Trabajo propio (dominio público) a través de Commons Wikimedia
2. "Holes redox" de Cameron Garnham - Trabajo propio (CC By -SA 3.0) a través de Commons Wikimedia


