Diferencia entre metano y etano

Diferencia clave: metano vs etano
El metano y el etano son los miembros más pequeños de la familia Alkane. Las fórmulas moleculares de estos dos compuestos orgánicos son CH4 y C2H6 respectivamente. El diferencia clave entre metano y etano es su estructura química; Una molécula de etano puede considerarse como dos grupos metilo unidos como un dímero de los grupos metilo. Las otras diferencias químicas y físicas surgen principalmente debido a esta diferencia estructural.
Que es metano?
El metano es el miembro más pequeño de la familia Alkane con la fórmula química4 (Cuatro átomos de hidrógeno se unen a un átomo de carbono). Se considera el componente principal del gas natural. El metano es un gas incoloro, inodoro e insípido; también conocido como carbano, gas pantanino, gas natural, tetrahidruro de carbono, y carburo de hidrógeno. Se puede encender fácilmente y su vapor es más ligero que el aire.
El metano se encuentra naturalmente debajo del suelo y debajo del fondo del mar. El metano atmosférico se considera como un gas de efecto invernadero. El metano se descompone en CH3- con agua en la atmósfera. 
Que es el etano?
El etano es un compuesto gaseoso incoloro e inodoro a temperatura y presión estándar. Su fórmula molecular y peso molecular son c2H6 y 30.07 g · mol−1 respectivamente. Está aislado del gas natural, como un subproducto del proceso de refinación de petróleo. El etano es muy importante en la producción de etileno. 
¿Cuál es la diferencia entre metano y etano??
Características del metano y el etano
Estructura:
Metano: El fórmula molecular de metano es Pez4, y es un ejemplo de una molécula tetraédrica con cuatro enlaces C-H equivalentes (enlaces sigma). El ángulo de enlace entre los átomos de H-C-H es 109.50 y todos los enlaces C-H son equivalentes, y es igual a 108.70 pm.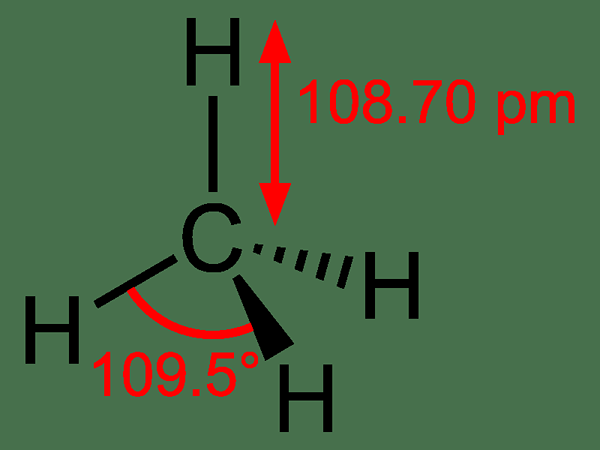
Etano: El fórmula molecular del etano es C2H6, y es un hidrocarburo saturado ya que no contiene múltiples enlaces.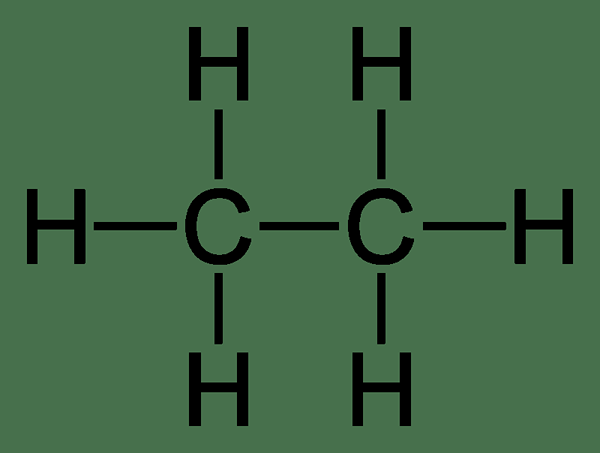
Propiedades químicas:
Metano:
Estabilidad: El metano es una molécula químicamente muy estable que no reacciona con KMNO4, K2CR2O7, H2ENTONCES4 o HNO3 bajo condiciones normales.
Combustión: En presencia de exceso de aire u oxígeno, el metano se quema con una llama no luminosa de color azul pálido que produce dióxido de carbono y agua. Es una reacción altamente exotérmica; Por lo tanto, se usa como un excelente combustible. En presencia de aire u oxígeno insuficiente, se quema parcialmente en gas de monóxido de carbono (CO).
Reacciones de sustitución: El metano muestra reacciones de sustitución con halógenos. En estas reacciones, uno o más átomos de hidrógeno se reemplazan por un número igual de átomos de halógeno y se llama "halogenación."Reacciona con cloro (CL) y bromo (BR) en presencia de la luz solar.
Reacción con vapor: Cuando se pasa una mezcla de metano y vapor a través de un níquel calentado (1000 K) soportado en la superficie de alúmina, puede producir hidrógeno.
Pirólisis: Cuando el metano se calienta a aproximadamente 1300 K, se descompone al negro de carbono e hidrógeno.
Etano:
Reacciones: Gas etano (CH3Pez3) reacciona con vapor de bromo en presencia de luz para formar bromoetano (CH3Pez2Br) y bromuro de hidrógeno (HBR). Es una reacción de sustitución; Un átomo de hidrógeno en etano se sustituye por el átomo de bromo.
Pez3Pez3 + BR2 à ch3Pez2Br +HBR
Combustión: La combustión completa del etano produce 1559.7 kJ/mol (51.9 kJ/g) de calor, dióxido de carbono y agua.
2 C2H6 + 7 O2 → 4 CO2 + 6 H2O + 3120 kj
También puede ocurrir sin un exceso de oxígeno, produciendo una mezcla de carbono amorfo y monóxido de carbono.
2 C2H6 + 3 O2 → 4 C + 6 H2O + energía
2 C2H6 + 5 O2 → 4 CO + 6 H2O + energía
2 C2H6 + 4 O2 → 2 C + 2 CO + 6 H2O + Energía, etc.
Definiciones:
Reacciones de sustitución: la reacción de sustitución es una reacción química que implica el desplazamiento de un grupo funcional en un compuesto químico y lo reemplaza por otro grupo funcional.
Usos:
Metano: El metano se usa en muchos procesos químicos industriales (como combustible, gas natural, gas natural licuado) y se transporta como un fluido refrigerado.
Etano: El etano se usa como combustible para motores y como refrigerante para un sistema de temperatura extremadamente baja. Se envía en cilindros de acero como un gas licuado bajo su propia presión de vapor.
Referencias: "etano". Wikipedia. norte.pag., 2016. Web. 7 de junio de 2016. Khanna, bhishm. "¿Cuáles son las propiedades químicas del metano? ?". Preservantes.comunicarse. norte.pag., 2016. Web. 7 de junio de 2016. "Metano | CH4 - PubChem ". Pubchem.NCBI.NLM.NIH.gobierno. norte.pag., 2016. Web. 7 de junio de 2016. "Metano". Wikipedia. norte.pag., 2016. Web. 7 de junio de 2016. Imagen cortesía: "Modelo de molécula de metano de bola y palo" por (dominio público) a través de Commons wikimedia "modelo de molécula de etano" y ben molécula-trabajo propio (dominio público) a través de commons wikimedia "metano" por Jynto-Trabajo propio, basado en el archivo: metano-CRC-MW-Dimensions-2D.PNG, (dominio público) a través de Commons Wikimedia "etano" (dominio público) a través de Commons Wikimedia

