Diferencia entre el grupo de metilo y metileno
El diferencia clave entre el grupo de metilo y metileno es que el El grupo metilo contiene un átomo de carbono unido a tres átomos de hidrógeno, mientras que el grupo de metileno contiene un átomo de carbono unido a dos átomos de hidrógeno.
El grupo metilo y el grupo de metileno son grupos funcionales importantes en las moléculas orgánicas. Estos grupos funcionales se forman a partir de las moléculas de metano. La estructura química del grupo metilo es CH3- mientras que la estructura química del grupo de metileno es CH2-.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es un grupo metilo?
3. ¿Qué es un grupo de metileno?
4. Comparación de lado a lado: metilo vs grupo de metileno en forma tabular
5. Resumen
¿Qué es un grupo metilo??
El grupo metilo es un grupo funcional en un compuesto orgánico, y tiene la fórmula química CH3-. Este grupo funcional se deriva de la molécula de metano, CH4. Podemos abreviar a este grupo como "yo". Además, el grupo metilo contiene un átomo de carbono unido a tres átomos de hidrógeno. Además, este es un grupo de hidrocarburos que ocurre en moléculas orgánicas. En la mayoría de las moléculas, este es un grupo funcional muy estable.
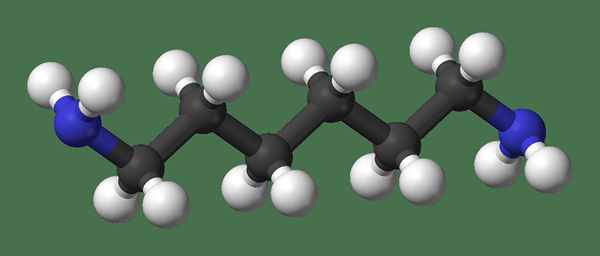
En general, el grupo metilo ocurre como parte de un gran compuesto orgánico. Este grupo funcional puede existir de tres maneras diferentes: como anión, un catión o como radical. El anión del grupo metilo tiene ocho electrones de valencia. El catión tiene seis electrones de valencia, y el radical tiene siete electrones de valencia. Sin embargo, las tres formas son reactivas y no se pueden observar como especies individuales.
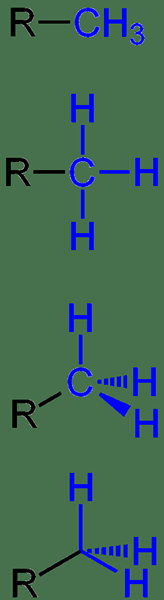
Figura 01: Grupo metilo en diferentes formas en diferentes compuestos
Al considerar su reactividad, a menudo tiende a ser poco reactivo. Por ejemplo, los grupos metilo no se ven afectados incluso por un ácido fuerte cuando el grupo metilo está en un compuesto orgánico. Sin embargo, su reactividad depende de los sustituyentes adyacentes. La oxidación de los grupos metilo es importante en aplicaciones industriales. Los productos derivados de la oxidación del grupo metilo incluyen alcohol, aldehído y grupos de ácido carboxílico. Por ejemplo, el permanganato (un oxidante fuerte) puede oxidar el grupo metilo en un grupo de ácido carboxílico.
¿Qué es un grupo de metileno??
El grupo de metileno es un grupo funcional en compuestos orgánicos y tiene la fórmula química2-. Como lo indica la fórmula química, este grupo tiene un átomo de carbono unido a dos átomos de hidrógeno. En general, este grupo funcional se abrevia como CH2< because the methylene group can form two more covalent bonds that are represented by the < symbol.

Figura 02: un grupo de metileno que contiene un compuesto orgánico
Sin embargo, este grupo no se une con el compuesto orgánico a través de un doble enlace; solo forma dos enlaces individuales. Si hay un doble enlace, entonces llamamos a este grupo funcional como "grupo de metilideno".
¿Cuál es la diferencia entre el grupo de metilo y metileno??
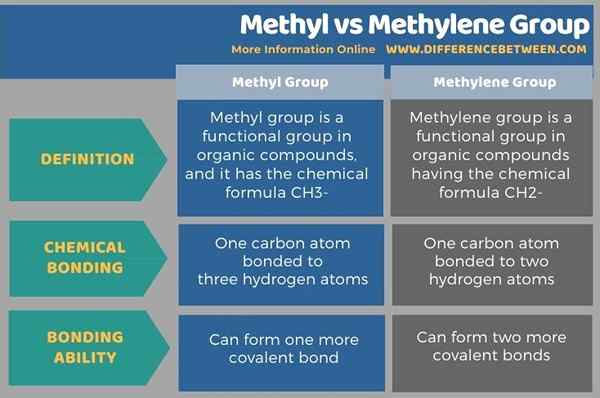
El grupo metilo y el grupo de metileno son grupos funcionales importantes en las moléculas orgánicas. La diferencia clave entre el grupo de metilo y metileno es que el grupo metilo contiene un átomo de carbono unido a tres átomos de hidrógeno, mientras que el grupo de metileno contiene un átomo de carbono unido a dos átomos de hidrógeno. Además, la estructura química del grupo metilo es CH3- y la estructura química del grupo de metileno es CH2-.
Debajo de la infografía resume las diferencias entre el grupo metilo y metileno.
Resumen -Grupo de metil vs metileno
El grupo metilo y el grupo de metileno son grupos funcionales importantes en las moléculas orgánicas. La diferencia clave entre el grupo de metilo y metileno es que el grupo metilo contiene un átomo de carbono unido a tres átomos de hidrógeno, mientras que el grupo de metileno contiene un átomo de carbono unido a dos átomos de hidrógeno.
Referencia:
1. Helmenstine, Anne Marie. “Definición del grupo metilo en química."Thinkco, febrero. 11, 2020, disponible aquí.
2. "Grupo metilo."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 21 de noviembre. 2018, disponible aquí.
Imagen de cortesía:
1. "Metilo General Fórmulas V" de Jü - Trabajo propio (dominio público) a través de Commons Wikimedia
2. "1,6-diaminohexano-3D-balls" por Ben Mills-Trabajo propio (dominio público) a través de Commons Wikimedia


