Diferencia entre micelas y partículas coloidales
El diferencia clave entre micelas y partículas coloidales es que Las micelas se forman a cierta concentración, mientras que las partículas coloidales se forman tan pronto como se agregan los solutos al solvente.
Los términos micelles y partículas coloidales vienen en química analítica donde se discuten los coloides. Las micelas también son un tipo de partículas coloidales.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son las micelas?
3. ¿Qué son las partículas coloidales?
4. Comparación lado a lado: micelas frente a partículas coloidales en forma tabular
5. Resumen
¿Qué son las micelas??
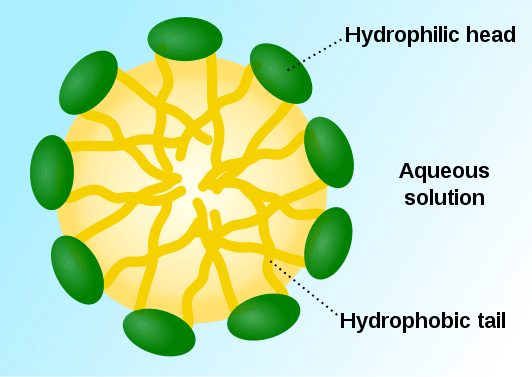
Las micelas son partículas coloidales que se forman como agregados de moléculas tensioactivas. Estos se dispersan en un medio líquido y se producen como coloides líquidos. Las moléculas tensioactivas tienen cabezas hidrofílicas y colas hidrofóbicas. En un medio acuoso, las estructuras hidrofóbicas de cola única tienden a repeler las moléculas de agua, mientras que las cabezas hidrofílicas tienden a atraer las moléculas de agua. Como resultado, se forma un agregado de tal manera que las cabezas hidrofílicas están en contacto con el disolvente, que rodea las colas hidrofóbicas dentro de la micela.

Figura 01: Estructura de una micela típica
Las micelas son esféricas en su forma. Además, también son posibles algunas otras formas, como elipsoides, estructuras cilíndricas y bicapas. La forma de la micela está determinada por algunos factores, como la geometría molecular de la molécula tensioactiva, la concentración de tensioactivo en la solución, la temperatura, el pH y la resistencia iónica. El proceso de formación de micelas se llama micelización.
Además, las micelas se forman cuando la concentración del tensioactivo es mayor que la concentración crítica de micelas de la solución. Además, la temperatura del sistema debe ser más alta que la temperatura crítica de las micelas. Por lo general, las micelas se forman espontáneamente debido al equilibrio entre la entropía y la entalpía de la mezcla de tensioactivo-solvente.
¿Qué son las partículas coloidales??
Las partículas coloidales son las partículas que se dispersan en una suspensión. Este tipo de suspensión se llama suspensión coloidal. Las partículas suspendidas pueden ser solubles o de partículas insolubles. Un coloid tiene dos fases distintivas de la materia: solvente de fase líquida y partículas de fase sólida. La fase líquida se llama fase continua, y la fase sólida se llama fase dispersa, que se dispersa en todo el solvente. Por lo general, las partículas coloidales no se asientan o tardan mucho tiempo en establecerse.

Figura 02: En la leche, las partículas coloidales son glóbulos de grasa de mariposas
Las partículas coloidales son fácilmente visibles a través de un microscopio óptico. Algunos coloides son opacos, pero otros son translúcidos. La naturaleza translúcida se debe al efecto Tyndall de la dispersión de la luz. Hay varios tipos diferentes de coloides, dependiendo del tipo de fase líquida y fase dispersa. Los siguientes son algunos ejemplos.
- Si el disolvente es líquido y la fase dispersa es gas, llamamos a este coloide espuma. Las partículas coloidales son agregados gaseosos. mi.gramo. crema batida.
- Si el disolvente es una fase sólida y dispersa es un gas, entonces lo llamamos espuma sólida. Aquí también, las partículas coloidales son agregados gaseosos. mi.gramo. aerogel.
- Si la fase solvente es de gas y la fase dispersa es líquida, la llamamos aerosol líquido. Las partículas coloidales son agregados líquidos. mi.gramo. aerosoles.
- Si la fase solvente es líquida y la fase dispersa también es líquida, la llamamos emulsión. mi.gramo. leche.
- Si la fase solvente es sólida y la fase dispersa es líquida, la llamamos gel. Las partículas coloidales aquí son agregados líquidos. mi.gramo. agar.
- Si la fase solvente es de gas y la fase dispersa es sólida, la llamamos aerosol sólido. mi.gramo. fumar.
- Si la fase solvente es líquida y la fase dispersa es sólida, la llamamos como "Sol". Las partículas coloidales aquí son agregados sólidos. mi.gramo. sangre.
- Si la fase solvente es sólida y el medio disperso también es sólido, la llamamos Sol sólido. Las partículas coloidales aquí son agregados sólidos. mi.gramo. vidrio de arándano.
¿Cuál es la diferencia entre micelas y partículas coloidales??
Las micelas también son un tipo de partículas coloidales. La diferencia clave entre las micelas y las partículas coloidales es que se forman micelas a una cierta concentración, mientras que las partículas coloidales se forman tan pronto como se agregan los solutos al solvente. Además, las micelas se forman debido a los efectos hidrofílicos e hidrofóbicos, mientras que las partículas coloidales se forman debido a la insolubilidad o saturación de la solución.
Además, el tamaño de las micelas puede variar de 2 a 20 nanómetros, mientras que el tamaño de las partículas coloidales puede variar de 1 a 1000 nanómetros.
La tabulación a continuación muestra más comparaciones relacionadas con la diferencia entre micelas y partículas coloidales.

Resumen -Micelas vs partículas coloidales
Los términos micelles y partículas coloidales vienen en química analítica donde se discuten los coloides. Las micelas también son un tipo de partículas coloidales. La diferencia clave entre las micelas y las partículas coloidales es que se forman micelas a una cierta concentración, mientras que las partículas coloidales se forman tan pronto como se agregan los solutos al solvente.
Referencia:
1. "Micela." Enciclopía Britannica, Encyclopædia Britannica, Inc., 2 de febrero. 2018, disponible aquí.
Imagen de cortesía:
1. "Micelle Scheme-en" de Supermanu-Trabajo propio (CC By-Sa 3.0) a través de Commons Wikimedia
2. "Vaso de leche en el mantel" de I, Chedid (CC By-SA 3.0) a través de Commons Wikimedia


