Diferencia entre MNO2 y Cuo

El diferencia clave Entre MNO2 y Cuo es que MnO2 es el óxido de manganeso, mientras que Cuo es el óxido de cobre.
MNO2 y CuO son compuestos inorgánicos que tienen una apariencia similar, existentes como sólidos negruzcos a temperatura ambiente. Por lo tanto, es muy difícil distinguir estos dos compuestos sólidos simplemente mirándolos, por lo que necesitamos diferentes procedimientos experimentales para identificarlos por separado. Como una diferencia básica, tienen diferentes composiciones químicas; MNO2 tiene manganeso en su forma de óxido, mientras que el compuesto CuO tiene cobre en su forma de óxido, que tiene el cobre en estado de oxidación +2.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es mno2?
3. Que es cuo
4. Comparación de lado a lado - MNO2 vs CUO en forma tabular
5. Resumen
¿Qué es mno2??
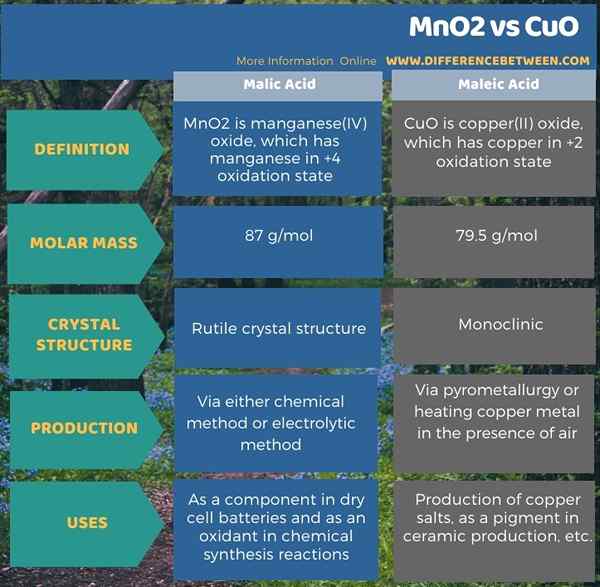
MNO2 es óxido de manganeso (IV) que tiene manganeso en estado de oxidación +4. Aparece como un sólido marrón negruzco a temperatura ambiente. Naturalmente, ocurre en forma mineral pirolusita. El nombre IUPAC preferido para este compuesto es el óxido de manganeso (iv). La masa molar de MNO2 es de 87 g/moles. Es un sólido insoluble en agua. Hay varias aplicaciones de MNO2. Es principalmente útil como componente en baterías de celdas secas. Además, es importante en la síntesis orgánica como oxidante.
Hay varios polimorfos conocidos y formas hidratadas de MNO2. Además, este compuesto cristaliza en forma de una estructura cristalina de rutilo. Tiene un centro de metal octaédrico y tres óxidos coordinados.

Hay dos posibles métodos de producción de dióxido de manganeso (MNO2); son el método químico y el método electrolítico. El método químico comienza con dióxido de manganeso natural, que tiene impurezas. Tenemos que convertir este MNO2 natural en nitrato de manganeso (II) con tetroxido de dinitrógeno con agua. Al calentar, la sal de nitrato se evapora, liberando n2O4, y podemos observar el dióxido de manganeso restante, que está en forma pura. El método electrolítico también es un método útil en la producción de MNO2. Aquí, depósitos de dióxido de manganeso puro en el ánodo.
Que es cuo?
Cuo es óxido de cobre (ii). Tiene cobre en el estado de oxidación de +2. Aparece como un sólido marrón negruzco a temperatura ambiente. Es uno de los dos óxidos más estables de cobre. En la naturaleza, el óxido de cobre ocurre en una forma mineral llamada tenorito. El nombre IUPAC de este compuesto es el óxido de cobre (ii). La masa molar es 79.5 g/mol. Es insoluble en agua. Además, tiene una estructura cristalina monoclínica. Aquí, un átomo de cobre se asocia con cuatro átomos de oxígeno en una geometría de planar cuadrado.

La pirometalurgia es el método que utilizamos comúnmente para la producción de CUO. Aquí, podemos extraer óxido de cobre de su mineral. En este proceso, necesitamos tratar el mineral con una mezcla de carbonato de amonio acuoso, amoníaco y oxígeno. Este tratamiento inicialmente proporciona complejos amminos de cobre (i) y cobre (ii). Entonces podemos descomponer estos complejos para obtener cuo puro. Además, podemos producir este compuesto mediante calentamiento de metal de cobre en presencia de oxígeno también.
¿Cuáles son las similitudes entre MNO2 y Cuo??
- Tanto MNO2 como CuO tienen la misma apariencia de color marrón negruzco, y existen en la fase sólida a temperatura ambiente.
- Estos compuestos son insolubles en agua.
¿Cuál es la diferencia entre MNO2 y Cuo??
La diferencia clave entre MNO2 y CuO es que MnO2 es el óxido de manganeso, mientras que CuO es el óxido de cobre. Además, en MNO2, el átomo de metal está en estado de oxidación de +4, mientras que en CuO, el átomo de metal está en estado de oxidación +2.
Además, otra diferencia entre MNO2 y Cuo es que MNO2 tiene una estructura cristalina de rutilo, mientras que CuO tiene una estructura monoclínica.
Resumen -MNO2 vs Cuo
Tanto MNO2 como CuO tienen la misma apariencia de color marrón negruzco, y existen en la fase sólida a temperatura ambiente. La diferencia clave entre MNO2 y CuO es que MnO2 es el óxido de manganeso, mientras que CuO es el óxido de cobre.
Referencia:
1. Helmenstine, Anne Marie. "Hechos de manganeso."Thinkco, Jul. 3, 2019, disponible aquí.
Imagen de cortesía:
1. "Manganeso (IV) óxido" por Walkerma asumió: no se proporciona una fuente legible por máquina. Trabajo propio asumido (basado en reclamos de derechos de autor) (dominio público) a través de Commons Wikimedia
2. "Copperiioxido" por el usuario Walkerma en EN.Wikipedia, dominio público) a través de Commons Wikimedia


