Diferencia entre orbital molecular y orbital atómico

El diferencia clave entre el orbital molecular y el orbital atómico es que Los orbitales atómicos describen las ubicaciones donde la probabilidad de encontrar los electrones es alta en un átomo, mientras que los orbitales moleculares describen las ubicaciones probables de los electrones en una molécula.
La unión en las moléculas se entendió de una nueva manera con las nuevas teorías presentadas por Schrodinger, Heisenberg y Paul Dirac. Cuando la mecánica cuántica entró en la imagen con sus hallazgos, se descubrió que un electrón tiene propiedades de partículas y de onda. Con esto, a Schrodinger desarrolló ecuaciones para encontrar la naturaleza de onda de un electrón y se le ocurrió la ecuación de onda y la función de onda. La función de onda (ψ) corresponde a diferentes estados para el electrón.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es un orbital molecular?
3. ¿Qué es un orbital atómico?
4. Comparación de lado a lado: orbital molecular vs orbital atómico en forma tabular
5. Resumen
¿Qué es un orbital molecular??
Los átomos se unen para formar moléculas. Cuando dos átomos se acercan para formar una molécula, los orbitales atómicos se superponen y se combinan para convertirse en orbitales moleculares. El número de orbitales moleculares recién formados es igual al número de orbitales atómicos combinados. Además, el orbital molecular rodea los dos núcleos de los átomos, y los electrones pueden moverse alrededor de ambos núcleos. Similar a los orbitales atómicos, los orbitales moleculares contienen al máximo 2 electrones, que tienen giros opuestos.
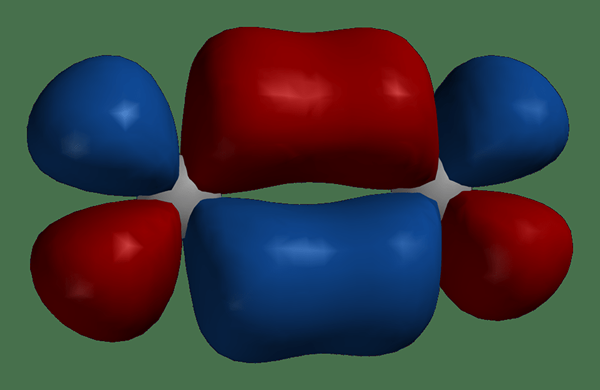
Figura 01: Orbitales moleculares en una molécula
Además, hay dos tipos de orbitales moleculares: unión de orbitales moleculares y orbitales moleculares de antibonding. Los orbitales moleculares de unión contienen electrones en el estado fundamental, mientras que los orbitales moleculares de antibonding no contienen electrones en el estado fundamental. Además, los electrones pueden ocupar orbitales de antibonding si la molécula está en estado excitado.
¿Qué es un orbital atómico??
Max Born señaló un significado físico al cuadrado de la función de onda (ψ2) después de que Schrodinger presentó su teoría. Según Born, ψ2 expresa la probabilidad de encontrar un electrón en una ubicación particular; Si ψ2 es un valor grande, entonces la probabilidad de encontrar el electrón en ese espacio es mayor. Por lo tanto, en el espacio, la densidad de probabilidad de electrones es grande. Sin embargo, si el ψ2 es bajo, entonces la densidad de probabilidad de electrones es baja. Las gráficas de ψ2 en los ejes x, y y z muestran estas probabilidades, y toman la forma de los orbitales S, P, D y F. Llamamos a estos orbitales atómicos.

Figura 02: diferentes orbitales atómicos
Además, definimos un orbital atómico como una región del espacio donde la probabilidad de encontrar un electrón es grande en un átomo. Podemos caracterizar estos orbitales mediante números cuánticos, y cada orbital atómico puede acomodar dos electrones con giros opuestos. Por ejemplo, cuando escribimos la configuración de electrones, la escribimos como 1S2, 2S2, 2P6, 3S2. 1, 2, 3 .. .n Los valores enteros son los números cuánticos. El superíndice después del nombre orbital muestra el número de electrones en ese orbital. Los orbitales S tienen forma de esfera, y pequeños mientras los orbitales P tienen forma de mancuerna con dos lóbulos. Aquí, un lóbulo es positivo, mientras que el otro lóbulo es negativo. Además, el lugar donde dos lóbulos se tocan el nodo es. Hay 3 orbitales P como X, Y y Z. Están dispuestos en el espacio de tal manera que sus ejes sean perpendiculares entre sí.
Hay cinco orbitales D y 7 orbitales F con diferentes formas. Por lo tanto, los siguientes son el número total de electrones que pueden residir en un orbital.
- S Orbital-2 Electrones
- P Orbitals: 6 electrones
- D Orbitales: 10 electrones
- F Orbitales: 14 electrones
¿Cuál es la diferencia entre orbital molecular y orbital atómico??
La diferencia clave entre el orbital molecular y el orbital atómico es que los orbitales atómicos describen las ubicaciones donde la probabilidad de encontrar los electrones es alta en un átomo, mientras que los orbitales moleculares describen las ubicaciones probables de los electrones en una molécula de molécula. Además, los orbitales atómicos están presentes en los átomos, mientras que los orbitales moleculares están presentes en las moléculas. Además, la combinación de orbitales atómicos da como resultado la formación de orbitales moleculares. Además, los orbitales atómicos se nombran como S, P, D y F, mientras que hay dos tipos de orbitales moleculares como orbitales moleculares de enlace y antibonding.
Resumen -Orbital molecular vs orbital atómico
La diferencia clave entre el orbital molecular y el orbital atómico es que los orbitales atómicos describen las ubicaciones donde la probabilidad de encontrar los electrones es alta en un átomo, mientras que los orbitales moleculares describen las ubicaciones probables de los electrones en una molécula de molécula.
Referencia:
1. Helmenstine, Anne Marie. "Definición y ejemplo orbitales."Thoughtco, puede. 7, 2019, disponible aquí.
Imagen de cortesía:
1. "Modelo de llenado del espacio de un enlace PI (orbital molecular de unión con simetría π) generado por la superposición de ..." por Ben Mills (dominio público) a través de archivos de dominio público
2. "Normas atómicas-orbitales SPD M0" por Geek3-Trabajo propio; Creado con nube de hidrógeno en Pythonthis PNG Graphic se creó con Python (CC BY-SA 4.0) a través de Commons Wikimedia


