Diferencia entre la teoría orbital molecular y la teoría de la hibridación
El diferencia clave entre la teoría orbital molecular y la teoría de la hibridación es que La teoría del orbital molecular describe la formación de orbitales de unión y anti-enlace, mientras que la teoría de la hibridación describe la formación de orbitales híbridos.
Existen diferentes teorías desarrolladas para determinar las estructuras electrónicas y orbitales de las moléculas. Teoría VSEPR, teoría de Lewis, teoría de enlaces de valencia, teoría de la hibridación y teoría del orbital molecular son teorías tan importantes. La teoría más aceptable entre ellos es la teoría del orbital molecular.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la teoría orbital molecular?
3. ¿Qué es la teoría de la hibridación?
4. Comparación de lado a lado - Teoría orbital molecular frente a la teoría de la hibridación
5. Resumen
¿Qué es la teoría orbital molecular??
La teoría orbital molecular es una técnica para describir la estructura electrónica de las moléculas utilizando la mecánica cuántica. Es la forma más productiva de explicar la unión química en las moléculas. Discutamos esta teoría en detalle.
Primero, necesitamos saber cuáles son. Un enlace químico se forma entre dos átomos cuando la red de la red atractiva entre dos núcleos atómicos y los electrones entre ellos excede la repulsión electrostática entre dos núcleos atómicos. Básicamente, esto significa que las fuerzas atractivas entre dos átomos deberían ser más altas que las fuerzas repulsivas entre esos dos átomos. Aquí, los electrones deben existir en una región llamada "región de unión", para formar este enlace químico. Si no, los electrones estarán en la "región anti-vinculante" que ayudará a la fuerza repulsiva entre los átomos.
Sin embargo, si se cumplen los requisitos y se forma un enlace químico entre dos átomos, entonces los orbitales correspondientes involucrados en la unión se denominan orbitales moleculares. Aquí, podemos comenzar con dos orbitales de dos átomos y terminar con un orbital (el orbital molecular) que pertenece a ambos átomos.
Según la mecánica cuántica, los orbitales atómicos no pueden aparecer o desaparecer como deseamos. Cuando los orbitales interactúan entre sí, tienden a cambiar sus formas en consecuencia. Pero según la mecánica cuántica, son libres de cambiar la forma pero necesitan tener el mismo número de orbitales. Entonces necesitamos encontrar el orbital perdido. Aquí, la combinación en fase de los dos orbitales atómicos hace que el orbital de unión, mientras que la combinación fuera de fase, forma el orbital contra el enlace.
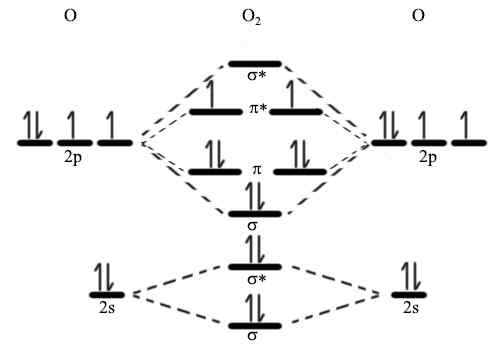
Figura 01: Diagrama orbital molecular
Los electrones de unión ocupan el orbital de unión, mientras que los electrones en el orbital anti-enlace no participan en la formación de enlaces. Más bien, estos electrones se oponen activamente a la formación del enlace químico. El orbital de unión tiene una energía potencial más baja que el orbital anti-Bonding. Si consideramos un enlace Sigma, la denotación para unir orbital es σ, y el orbital anti-vinculado es σ*. Podemos usar esta teoría para describir la estructura de las moléculas complicadas para explicar por qué no existen algunas moléculas (i.mi. Él2) y el orden de enlace de las moléculas. Por lo tanto, esta descripción explica brevemente la base de la teoría del orbital molecular.
¿Qué es la teoría de la hibridación??
La teoría de la hibridación es una técnica que utilizamos para describir la estructura orbital de una molécula. La hibridación es la formación de orbitales híbridos mezclando dos o más orbitales atómicos. La orientación de estos orbitales determina la geometría de la molécula. Es una expansión de la teoría de la valencia del enlace.
Antes de la formación de los orbitales atómicos, tienen diferentes energías, pero después de la formación, todos los orbitales tienen la misma energía. Por ejemplo, un orbital atómico S y un orbital atómico P pueden combinarse para formar dos orbitales SP. Los orbitales atómicos S y P tienen diferentes energías (energía de S < energy of p). But after the hybridization, it forms two sp orbitals which have the same energy, and this energy lies between the energies of individual s and p atomic orbital energies. Moreover, this sp hybrid orbital has 50% s orbital characteristics and 50% p orbital characteristics.

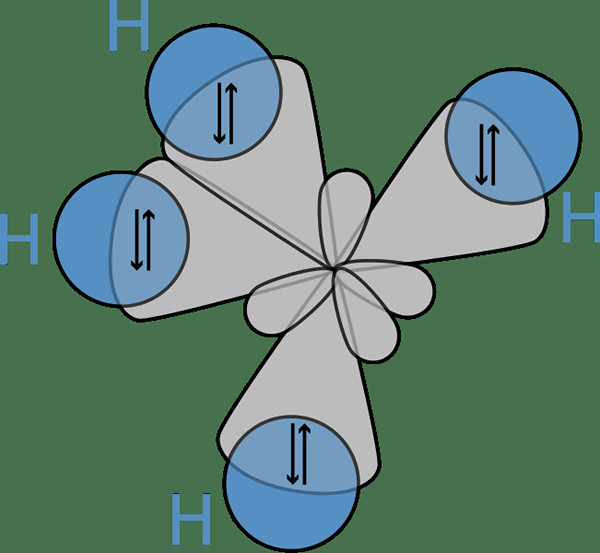
Figura 02: enlace entre los orbitales híbridos de un átomo de carbono y los orbitales S de los átomos de hidrógeno
La idea de la hibridación entró por primera vez en la discusión porque los científicos observaron que la teoría del enlace de valencia no pudo predecir correctamente la estructura de algunas moléculas como el CH4. Aquí, aunque el átomo de carbono tiene solo dos electrones no apareados según su configuración de electrones, puede formar cuatro enlaces covalentes. Para formar cuatro enlaces, debe haber cuatro electrones no apareados.
La única forma en que podían explicar este fenómeno era pensar que los orbitales de S y P del átomo de carbono se fusionan entre sí para formar nuevos orbitales llamados orbitales híbridos que tienen la misma energía. Aquí, uno s + tres p da 4 sp3 orbitales. Por lo tanto, los electrones llenan estos orbitales híbridos de manera uniforme (un electrón por orbital híbrido), obedeciendo la regla del Hund. Luego hay cuatro electrones para la formación de cuatro enlaces covalentes con cuatro átomos de hidrógeno.
¿Cuál es la diferencia entre la teoría orbital molecular y la teoría de la hibridación??
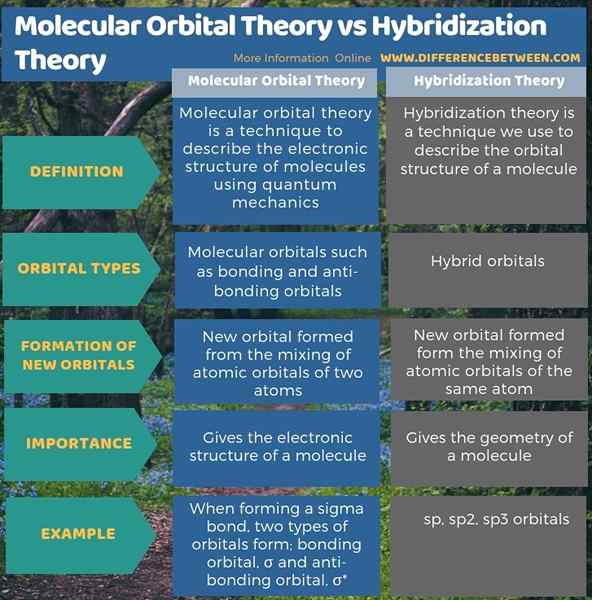
La teoría del orbital molecular es una técnica para describir la estructura electrónica de las moléculas utilizando la mecánica cuántica. La teoría de la hibridación es una técnica que utilizamos para describir la estructura orbital de una molécula. Entonces, la diferencia clave entre la teoría del orbital molecular y la teoría de la hibridación es que la teoría del orbital molecular describe la formación de orbitales de enlace y anti-vinculación, mientras que la teoría de la hibridación describe la formación de orbitales híbridos.
Además, según la teoría orbital molecular, las nuevas formas orbitales de la mezcla de orbitales atómicos de dos átomos, mientras que en la teoría de la hibridación, las nuevas formas orbitales forman la mezcla de orbitales atómicos del mismo átomo. Por lo tanto, esta es otra diferencia entre la teoría orbital molecular y la teoría de la hibridación.
Resumen -Teoría del orbital molecular frente a la teoría de la hibridación
Tanto la teoría del orbital molecular como la teoría de la hibridación son importantes para determinar la estructura de una molécula. La diferencia clave entre la teoría del orbital molecular y la teoría de la hibridación es que la teoría del orbital molecular describe la formación de orbitales de unión y anti-enlace, mientras que la teoría de la hibridación describe la formación de orbitales híbridos.
Referencia:
1. "Hibridación."Bibliotecas de química, Librettexts, 5 de junio de 2019, disponible aquí.
Imagen de cortesía:
1. "O2Molecularardiagramcr" por TCreuter - Trabajo propio (CC By -SA 4.0) a través de Commons Wikimedia
2. "Hibridación CH4" de K. Aainsqatsi en inglés wikipedia (texto original: k. Aainsqatsi) - trabajo propio (texto original: hecho a sí mismo) (dominio público) a través de Commons Wikimedia


