Diferencia entre la teoría orbital molecular y la teoría de los enlaces de valencia
El diferencia clave entre la teoría orbital molecular y la teoría de los enlaces de valencia es que La teoría del orbital molecular describe la formación orbital molecular, mientras que la teoría del enlace de valencia describe orbitales atómicas.
Diferentes moléculas tienen diferentes propiedades químicas y físicas que los átomos individuales que se unieron para formar estas moléculas. Para comprender estas diferencias entre las propiedades atómicas y moleculares, es necesario comprender la formación de enlaces químicos entre varios átomos para hacer una molécula. En la actualidad, utilizamos dos teorías mecánicas cuánticas para describir el enlace covalente y la estructura electrónica de las moléculas. Estos son la teoría de los enlaces de valencia y la teoría del orbital molecular.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la teoría orbital molecular?
3. ¿Qué es la teoría del enlace de valencia?
4. Comparación de lado a lado - Teoría orbital molecular frente a la teoría del enlace de valencia en forma tabular
5. Resumen
¿Qué es la teoría orbital molecular??
En las moléculas, los electrones residen en orbitales moleculares, pero sus formas son diferentes, y están asociados con más de un núcleo atómico. La teoría del orbital molecular es la descripción de las moléculas basadas en orbitales moleculares.
Podemos obtener la función de onda que describe un orbital molecular por la combinación lineal de orbitales atómicos. Un orbital de unión se forma cuando dos orbitales atómicos interactúan en la misma fase (interacción constructiva). Cuando interactúan fuera de fase (interacción destructiva), orbitales anti-vinculantes de. Por lo tanto, hay orbitales de unión y anti-enlace para cada interacción suborbital. Los orbitales de unión tienen baja energía, y los electrones tienen más probabilidades de residir en aquellos. Los orbitales anti-unidos son ricos en energía, y cuando se llenan todas las orbitales de unión, los electrones van y llenan los orbitales anti-vinculación.
¿Qué es la teoría del enlace de valencia??
La teoría del enlace de valencia se basa en el enfoque de enlace localizado, que supone que los electrones en una molécula ocupan orbitales atómicos de los átomos individuales. Por ejemplo, en la formación de la H2 molécula, dos átomos de hidrógeno se superponen a sus orbitales de 1. Al superponer los dos orbitales, comparten una región común en el espacio. Inicialmente, cuando los dos átomos están muy separados, no hay interacción entre ellos. Por lo tanto, la energía potencial es cero.
A medida que los átomos se acercan, cada electrón es atraído por el núcleo en el otro átomo y, al mismo tiempo, los electrones se repelen entre sí, al igual que los núcleos. Mientras que los átomos aún se separan, la atracción es mayor que la repulsión, por lo que la energía potencial del sistema disminuye. El punto en el que la energía potencial alcanza el valor mínimo, el sistema está en estabilidad. Esto es lo que sucede cuando dos átomos de hidrógeno se unen y forman la molécula.

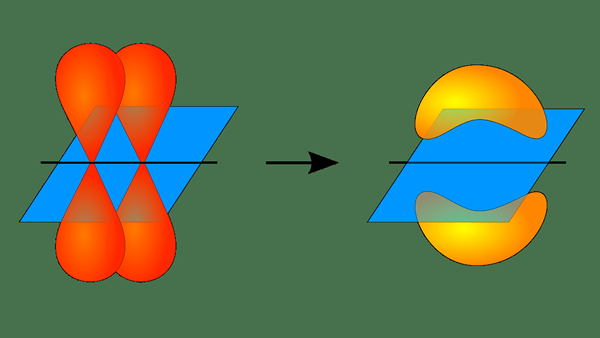
Figura 01: Formación de un enlace PI
Sin embargo, este concepto superpuesto solo puede describir moléculas simples como H2, F2, HF, etc. Esta teoría no explica moléculas como CH4. Sin embargo, este problema se puede resolver combinando esta teoría con la teoría orbital híbrida. La hibridación es la mezcla de dos orbitales atómicos no ascalentes. Por ejemplo, en CH4, C tiene cuatro sp hibridados3 orbitales superpuestos con los orbitales S de cada h.
¿Cuál es la diferencia entre la teoría del orbital molecular y la teoría del enlace de valencia??
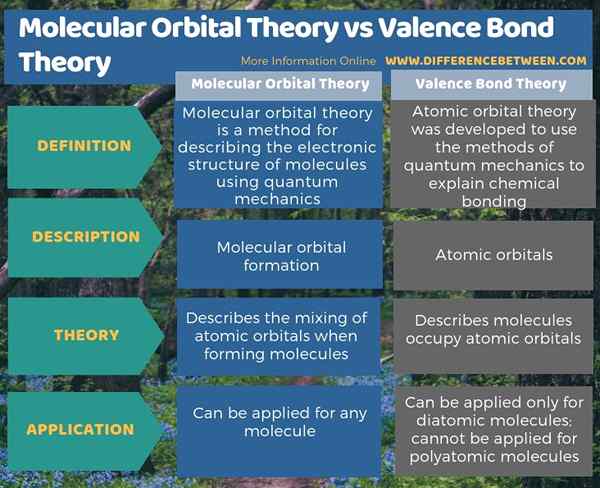
En la actualidad, utilizamos dos teorías mecánicas cuánticas para describir el enlace covalente y la estructura electrónica de las moléculas. Estos son la teoría de los enlaces de valencia y la teoría del orbital molecular. La diferencia clave entre la teoría orbital molecular y la teoría del enlace de valencia es que la teoría del orbital molecular describe la formación orbital molecular, mientras que la teoría del enlace de valencia describe las orbitales atómicas. Además, la teoría del enlace de valencia solo se puede aplicar para moléculas diatómicas, y no para moléculas poliatómicas. Sin embargo, podemos aplicar la teoría del orbital molecular para cualquier molécula.
Resumen -Teoría del orbital molecular frente a la teoría del enlace de valencia
La teoría del enlace de valencia y la teoría del orbital molecular son las dos teorías mecánicas cuánticas que describen el enlace covalente y la estructura electrónica de las moléculas. La diferencia clave entre la teoría orbital molecular y la teoría del enlace de valencia es que la teoría del orbital molecular describe la formación orbital molecular, mientras que la teoría del enlace de valencia describe las orbitales atómicas.
Referencia:
1. Helmenstine, Anne Marie. "Definición de la teoría del enlace de valencia (VB)."Thinkco, agosto. 4, 2019, disponible aquí.
Imagen de cortesía:
1. "Pi-Bond" de Pi-Bond.JPG: Jojanderivative Work: Vladsinger (Talk) - Pi -Bond.JPG (CC BY-SA 3.0) a través de Commons Wikimedia


