Diferencia entre sólido molecular y sólido de red covalente
El diferencia clave entre el sólido molecular y el sólido de la red covalente es que Formas sólidas moleculares debido a la acción de las fuerzas de Van der Waal, mientras que las formas sólidas de la red covalente debido a la acción de los enlaces químicos covalentes.
Podemos clasificar compuestos sólidos de diferentes maneras, dependiendo de la estructura, composición, enlace, propiedades, aplicaciones, etc. Sólidos moleculares, sólidos iónicos, sólidos metálicos, sólidos de red covalentes son tipos tan diferentes de sólidos.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el sólido molecular?
3. ¿Qué es la red covalente sólida?
4. Comparación de lado a lado: sólido molecular vs sólido de red covalente en forma tabular
5. Resumen
¿Qué es el sólido molecular??
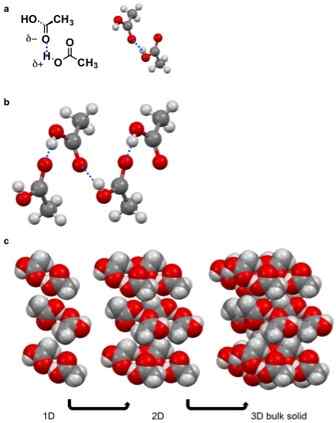
Un sólido molecular es un compuesto sólido que contiene moléculas unidas a través de las fuerzas de van der Waal. No hay enlaces iónicos o covalentes entre estas moléculas. Las fuerzas entre estas moléculas son fuerzas cohesivas de atracción. Existen diferentes tipos de fuerzas de van der Waal que pueden causar la formación de un sólido molecular, i.mi. Interacciones dipolo-dipolo, interacciones PI-PI, enlaces de hidrógeno, fuerzas de Londres, etc.

Figura 01: Formación de sólidos moleculares debido a la unión de hidrógeno
Sin embargo, estas fuerzas de Van der Waal son más débiles en comparación con los enlaces químicos iónicos y covalentes. Por lo tanto, los sólidos moleculares típicamente tienen puntos de fusión y ebullición relativamente bajos. Además, estos sólidos tienden a disolverse en solventes orgánicos. Estos sólidos moleculares tienen una baja densidad y también no son conductores; Por lo tanto, estos son aislantes eléctricos blandos.

Figura 02: el dióxido de carbono sólido y la cafeína sólida son sólidos moleculares
Además, al considerar los diferentes alotropos de un elemento químico, todos los alotropos a veces existen como sólidos moleculares, pero la mayoría de las veces, algunos alotropos son sólidos moleculares, mientras que otros alotropas del mismo elemento químico no son sólidos moleculares. Por ejemplo, existen diferentes formas alotrópicas de fósforo; Los nombramos como fósforo rojo, blanco y negro. Entre ellos, el fósforo blanco es un sólido molecular, pero el fósforo rojo existe como estructuras de cadena.
Además, los sólidos moleculares son dúctil o quebradizo dependen de la naturaleza de las caras de cristal del sólido. Tanto estas formas dúctiles y frágiles pueden sufrir una deformación elástica.
¿Qué es una red covalente sólida??
Los sólidos de la red covalente son compuestos sólidos que contienen átomos unidos entre sí a través de enlaces químicos covalentes. Estos sólidos tienen una serie de átomos repetidos vinculados entre sí a través de enlaces covalentes. La unión química puede causar la formación de una red de átomos, lo que conduce a la formación de una red sólida. Por lo tanto, podemos considerar una red covalente sólida como un tipo de macromolécula.
Además, estos sólidos pueden ocurrir de dos maneras; como sólidos cristalinos o sólidos amorfos. Un ejemplo adecuado para un sólido de red es el diamante con átomos de carbono unidos covalentemente, que forma una fuerte estructura 3D. Por lo general, los sólidos de la red covalente tienen puntos de fusión y ebullición relativamente altos. En general, estos sólidos son insolubles en cualquier tipo de solvente porque es muy difícil descomponer los enlaces entre los átomos. Además, estos sólidos son muy duros y tienen una baja conductividad eléctrica en su fase líquida. La conductividad eléctrica en la fase sólida puede variar según la composición.
¿Cuál es la diferencia entre sólido molecular y sólido de red covalente??
Los sólidos moleculares y los sólidos de la red covalente son dos tipos de compuestos sólidos. La diferencia clave entre el sólido molecular y el sólido de la red covalente es que las formas sólidas moleculares debido a la acción de las fuerzas de Van der Waal, mientras que las formas sólidas de la red covalente debido a la acción de los enlaces químicos covalentes. Al considerar sus propiedades, los sólidos moleculares son material relativamente blando, mientras que los sólidos de la red covalente son muy difíciles.
Además, los sólidos moleculares tienen puntos de fusión relativamente bajos, mientras que los sólidos de la red covalente tienen puntos de fusión muy altos. Además, los sólidos moleculares son aisladores eléctricos, mientras que los sólidos de la red covalente tienen baja conductividad eléctrica en el estado líquido y la conductividad eléctrica en la fase sólida puede variar según la composición. El hielo de agua es un buen ejemplo para los sólidos moleculares, mientras que Diamond es el mejor ejemplo de una red covalente sólida.
A continuación, la infografía resume la diferencia entre sólido molecular y sólido de red covalente.
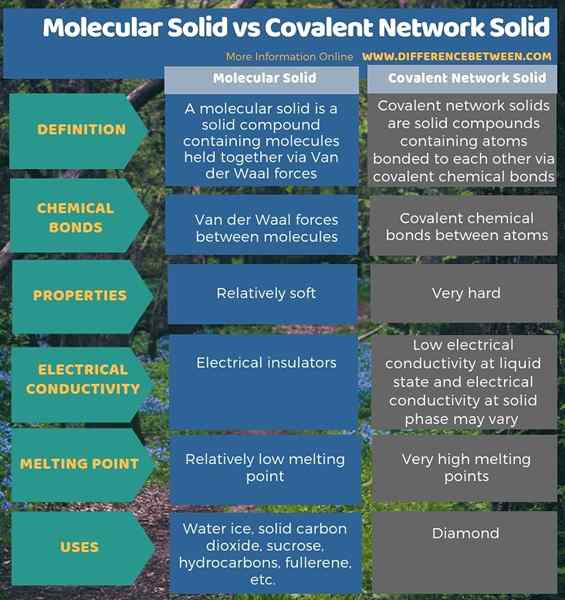
Resumen -Molecular Solid vs Covalent Network Solid
Los sólidos moleculares y los sólidos de la red covalente son dos tipos de compuestos sólidos. La diferencia clave entre el sólido molecular y el sólido de la red covalente es que las formas sólidas moleculares debido a la acción de las fuerzas de Van der Waal, mientras que las formas sólidas de la red covalente debido a la acción de los enlaces químicos covalentes.
Referencia:
1. Helmenstine, Anne Marie. "Sólidos moleculares: definición y ejemplos."Thinkco, dec. 3, 2018, disponible aquí.
2. Helmenstine, Anne Marie. "Definición sólida de la red en química."Thinkco, Jul. 8, 2019, disponible aquí.
Imagen de cortesía:
1. "Enlace de hidrógeno de ácido acético" por Cryst Eng 340 - Trabajo propio (CC BY -SA 4.0) a través de Commons Wikimedia
2. "Dióxido de carbono y cafeína" por Cryst Eng 340 - Trabajo propio (CC By -SA 4.0) a través de Commons Wikimedia


