Diferencia entre monatómico y diatómico
El diferencia clave entre monatómico y diatómico es que el Las especies monatómicas tienen un átomo, mientras que las especies diatómicas tienen dos átomos.
Por lo tanto, la diferencia entre monatómico y diatómico es principalmente con respecto a los átomos presentes en la especie. Como sugieren los nombres, ambos términos representan diferentes estados de asociaciones atómicas donde 'mono' significa 'uno' y 'di' significa 'dos.'Por lo tanto, simplemente, monatómico significa uno'un átomo'y medios diatómicos 'dos átomos.'
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es monatómico
3. ¿Qué es diatómico?
4. Comparación de lado a lado: monatómico vs diatómico en forma tabular
5. Resumen
Que es monatómico?
Cuando Un solo átomo existe por sí solo (que rara vez es el caso), lo llamamos monatómico. Eso significa que los elementos están en su forma singular pura. Sin embargo, el único ejemplo práctico que puede estar en esta categoría son los gases nobles que existen como átomos por su cuenta, ya que tienen su caparazón exterior con un octeto completo de electrones. Por lo tanto, no buscan aceptar ni donar más electrones para ser más estables. Por lo tanto, los gases nobles son estables en forma monatómica. Algunos ejemplos son; He - Helium, ne - neón, ar - argon, xe - xenon, kr - krypton, rn - radón.
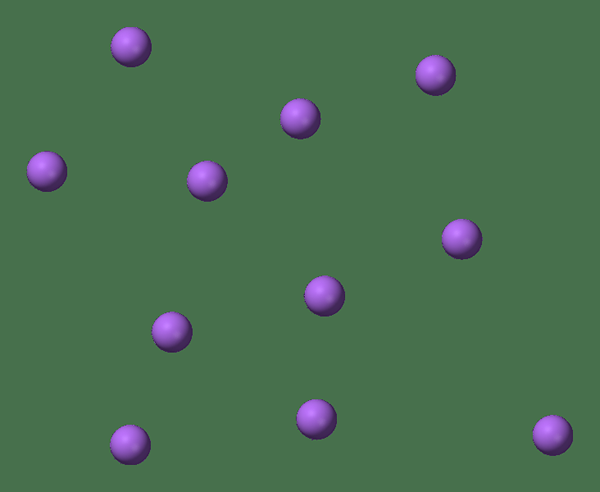
Figura 01: Monatómico significa tener átomos individuales
Además, también existen átomos individuales en formas iónicas, especialmente en soluciones, y algunos ejemplos son; N / A+, California2+, K+ etc. Estos iones tienen una carga fija sobre ellos, lo que significa que tienen una valencia constante. Pero, hay otros tipos de iones que tienen muchas valencias y pueden existir en muchas formas iónicas, que aún son monatómicas. Un buen ejemplo es el hierro; Ceñudo2+ y Fe3+. Por lo tanto, no solo los cationes (cargados positivamente) sino también los aniones (cargados negativamente) también existen en forma monatómica; CL-, F-, I- son pocos ejemplos que existen en forma monatómica. Estas especies iónicas no son estables por su cuenta y naturalmente buscarían contrapartes para formar compuestos.
Pero, como se mencionó anteriormente, podemos encontrarlos en soluciones sobre la hidrólisis de sus compuestos. Forma de especies iónicas debido a la falta de estabilidad del átomo único en una forma pura que no puede alcanzar la configuración electrónica de gas noble. Por lo tanto, estos átomos aceptan o donan electrones para obtener estabilidad.
¿Qué es diatómico??
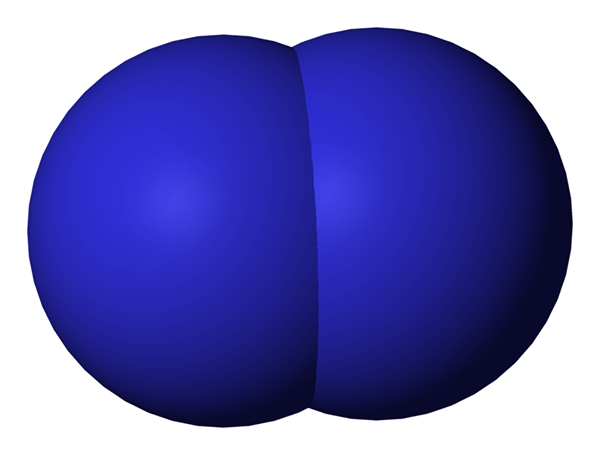
Cuando Dos átomos están en asociación entre sí, lo llamamos diatómico. Estos átomos pueden ocurrir como el mismo tipo o diferente. Cuando son dos átomos similares en asociación, lo llamamos 'diatomeas homonucleares'Y si consisten en diferentes tipos, lo llamamos'diatomeas heteronucleares'. Ejemplos de algunas diatomeas homonucleares serían O2, norte2, H2, etc. Mientras que CO, no, HCl, etc. se puede dar como ejemplos para diatomeas heteronucleares.

Figura 02: Diatomic significa tener dos átomos
Podemos considerar las diatomeas como compuestos porque forman estas asociaciones para lograr más estabilidad compartiendo electrones entre sí para que ambos átomos alcancen la configuración electrónica de gas noble. Pueden unirse a través de enlaces covalentes mediante la superposición de los orbitales atómicos o de lo contrario pueden formar enlaces iónicos entre ellos, lo cual es una fuerza de atracción entre una especie de catión (cargado positivamente) y una especie de anión (cargado negativamente). Ejemplos de enlaces covalentes entre diatomeas incluyen CO, no, etc. y consideramos HCL como una especie con carácter de atracción iónica. Sin embargo, como la fuerza de atracción entre h+ y CL- no es muy fuerte, no es un muy buen ejemplo para los enlaces iónicos el que es otro tema definido.
¿Cuál es la diferencia entre monatómico y diatómico??
El término monatómico se refiere a la presencia de un átomo, mientras que el término diatómico se refiere a la presencia de dos átomos en asociación entre sí. Por lo tanto, la diferencia clave entre monatómico y diatómico es que las especies monatómicas tienen un átomo, mientras que las especies diatómicas tienen dos átomos. Además, otra diferencia entre monatómico y diatómico es que las especies monatómicas son generalmente inestables con la excepción de los gases nobles, mientras que las especies diatómicas son generalmente estables porque hay un enlace químico entre los dos átomos que se forman para completar el octeto de electrones alrededor de cada uno. átomo.
La siguiente infografía muestra la diferencia entre monatómico y diatómico en forma tabular.

Resumen -Monatómico vs Diatómico
Los dos términos monatómico y diatómico describen el número de átomos presentes en una especie química. Por lo tanto, la diferencia clave entre monatómico y diatómico es que las especies monatómicas tienen un átomo, mientras que las especies diatómicas tienen dos átomos.
Referencia:
1. "Gas monatómico."Wikipedia, Fundación Wikimedia, 17 de septiembre. 2018. Disponible aquí
Imagen de cortesía:
1."Monatómico-Sodium-Gas-3D-VDW" de Benjah-BMM27-Trabajo propio, (Dominio público) a través de Commons Wikimedia
2."Dinitrógeno-3D-VDW" (dominio público) a través de Commons Wikimedia


