Diferencia entre monatómico y poliatómico
Monatómico vs poliatómico
El número de átomos presentes en un ion particular o una molécula es lo que contribuye a la diferencia entre monatómico y poliatómico. Las dos palabras "mono" y "poli" dan la idea general sobre la molécula; "Mono" significa "soltero" y "poli" significa "muchos."Monatómico se refiere a los iones o moléculas que tienen un solo átomo. Poliatómico se refiere a las moléculas o iones que tienen dos o más átomos. Hay tantas diferencias físicas y químicas entre monatómico y poliatómico debido a la diferencia en el número de átomos. En general, los elementos químicos monatómicos son menos abundantes en comparación con la existencia de moléculas poliatómicas.
Que es monatómico?
La palabra monatómica deriva de dos palabras "mono" y "atómica", dando el significado de "átomo único."Las especies químicas monatómicas contienen solo un átomo y son estables incluso si existen solos. Esto se puede aplicar a gases e iones. La mayoría de los gases nobles existen como especies químicas monatómicas.
Iones monatómicos: Estos iones se forman perdiendo (iones positivos) o obteniendo electrones (iones negativos).
Iones positivos: N / A+, K+, Ca2+, AL3+
Iones negativos: CL-, S2-, BR-, F-
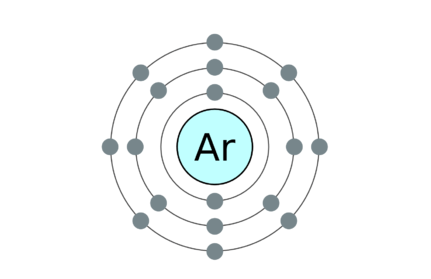
Moléculas monatómicas: Los gases nobles entran en esta categoría y son muy estables; Por lo tanto, químicamente inactivo.

18: Argón 2, 8, 8
Que es poliatómico?
La palabra poliatómica deriva de dos palabras "poli" y "atómica", significa muchos átomos. Puede ser átomos homogéneos (o2, Hg22+, O3, O22-) o una combinación de átomos heterogéneos (CN-, H2ENTONCES4, Clo3-). La mayoría de las moléculas y los iones existen como naturaleza poliatómica.
Iones poliatómicos: "Molecular iones" es otro nombre para los iones poliatómicos. La mayoría de los iones poliatómicos son especies químicas unidas covalentemente o complejos metálicos.
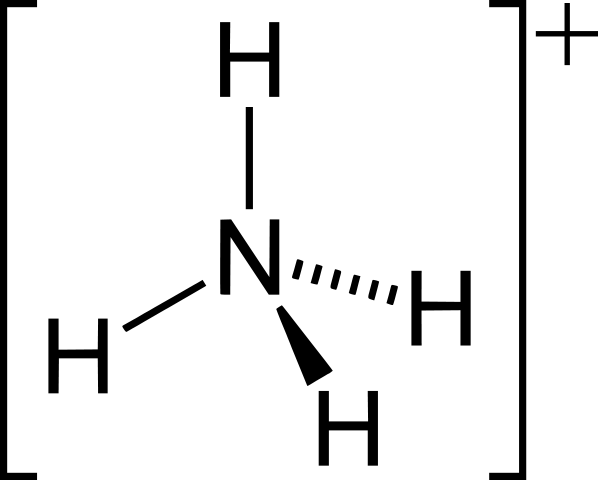
Iones positivos: NUEVA HAMPSHIRE4+, H3O+, Ph4+
Iones negativos: Cro42-, CO32-, Pez3ARRULLO-, ENTONCES42-, NO3-
Moléculas poliatómicas: Son las moléculas con dos o más átomos. No tienen una carga positiva o negativa. En otras palabras, estas moléculas son eléctricamente neutrales. (H2ENTONCES4, Pez3COOH, NA2CO3, NaCl, C2H4)
Amonio
¿Cuál es la diferencia entre monatómico y poliatómico??
• Número de átomos:
• Los elementos químicos monatómicos contienen Solo un átomo.
• Los compuestos químicos poliatómicos tienen Dos o más átomos.
• Estado:
• Las especies químicas monatómicas pueden ser iones o gases inertes.
• Algunas especies poliatómicas son iones y otras son moléculas.
• Propiedades
• La mayoría de los iones monatómicos son estables en agua.
• Las moléculas monatómicas son muy estables; Por lo tanto, químicamente inactivo.
• La mayoría de los iones poliatómicos están unidos covalentemente o complejos metálicos.
• Las moléculas poliatómicas son eléctricamente neutrales.
• Ejemplos para monatómico y poliatómico:
• Ejemplos para iones monatómicos son na+, California2+, K+, Alabama3+ y Fe3+.
• Ejemplos para moléculas monatómicas son gases nobles. Son Helium (He), Neon (NE), Argón (AR), Krypton (KR), Xenón (XE) y Radon (RA).
• Ejemplos para iones poliatómicos son cro42-, CO32-, NUEVA HAMPSHIRE4+, H3O+.
• Ejemplos para moléculas poliatómicas son kcl, kbro3, C6H5Cooh.
• Tamaño:
• El tamaño de la especie química monatómica difiere de acuerdo con la forma en que se forman. Por ejemplo, cuando se forman iones positivos, sus tamaños disminuyen y cuando se forman iones negativos, el tamaño aumenta que el átomo original. Los gases nobles tienen el tamaño más pequeño en comparación con los otros elementos en su período en la tabla periódica.
• Cuando se forman compuestos químicos poliatómicos, el tamaño del ion poliatómico o la molécula poliatómica se vuelve más grande que todos los átomos originales en el complejo. Porque, dos o más átomos se combinan para formar un ion /molécula poliatómica.
• Forma:
• En general, las moléculas y los iones monatómicos son esféricos en su geometría.
• La geometría de la especie química poliatómica varía según el número de moléculas y los pares solitarios presentes en la molécula. A medida que aumenta el número de átomos, se forman estructuras más complejas para alcanzar la estabilidad.
Imágenes Cortesía:
- Argón de Greg Robson (CC By-SA 2.0 Reino Unido)
- Amonio a través de wikicommons (dominio público)


