Diferencia entre la ecuación de Nernst y la ecuación de Goldman
El diferencia clave Entre la ecuación nernst y la ecuación de Goldman es que La ecuación de Nernst describe la relación entre el potencial de reducción y el potencial de electrodo estándar, mientras que la ecuación de Goldman es un derivado de la ecuación de Nernst y describe el potencial de inversión a través de una membrana celular.
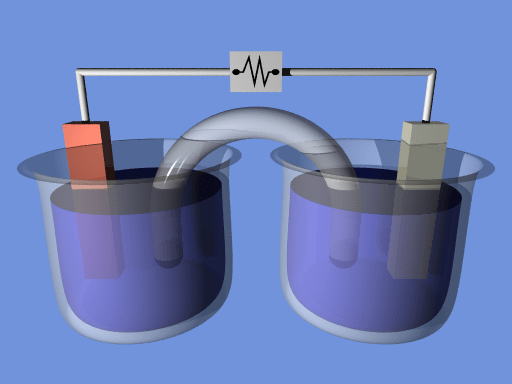
Una célula electroquímica es un dispositivo eléctrico que puede generar electricidad utilizando la energía química de las reacciones químicas. O de lo contrario podemos usar estos dispositivos para ayudar a las reacciones químicas al proporcionar la energía requerida de la electricidad. El potencial de reducción de una célula electroquímica determina la capacidad de la célula para producir electricidad.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la ecuación nernst?
3. ¿Qué es la ecuación de Goldman?
4. Comparación de lado a lado - ecuación nernst vs. Ecuación de Goldman en forma tabular
5. Resumen
¿Qué es la ecuación nernst??
La ecuación nernst es una expresión matemática que da la relación entre el potencial de reducción y el potencial de reducción estándar de una célula electroquímica. La ecuación lleva el nombre del científico Walther Nernst. Y, se desarrolló utilizando los otros factores que afectan las reacciones electroquímicas de oxidación y reducción, como la temperatura y la actividad química de las especies químicas que sufren oxidación y reducción.

Al derivar la ecuación de Nernst, debemos considerar los cambios estándar en la energía libre de Gibbs que se asocia con transformaciones electroquímicas que ocurren en la célula. La reacción de reducción de una célula electroquímica se puede administrar de la siguiente manera:
Buey+ z e- ⟶ rojo
Según la termodinámica, el cambio real de energía libre de la reacción es,
E = Ereducción - mioxidación
Sin embargo, la energía libre de Gibbs (ΔG) está relacionada con la E (diferencia de potencial) de la siguiente manera:
ΔG = -NFE
Donde n es el número de electrones transferidos entre especies químicas cuando la reacción está progresando, F es la constante de Faraday. Si consideramos las condiciones estándar, entonces la ecuación es la siguiente:
ΔG0 = -Nfe0
Podemos relacionar la energía libre de Gibbs de condiciones no estándar con la energía Gibbs de las condiciones estándar a través de la siguiente ecuación.
ΔG = ΔG0 + Rtlnq
Luego, podemos sustituir las ecuaciones anteriores en esta ecuación estándar para obtener la ecuación Nernst de la siguiente manera:
-nfe = -nfe0 + Rtlnq

Sin embargo, podemos reescribir la ecuación anterior utilizando los valores para Faraday Constant y R (Universal Gas Constant).
E = E0 - (0.0592vlnq/n)
¿Qué es la ecuación de Goldman??
La ecuación de Goldman es útil para determinar el potencial inverso a través de una membrana celular en la fisiología de la membrana celular. Esta ecuación lleva el nombre del científico David E. Goldman, quien desarrolló la ecuación. Y, se derivó de la ecuación nernst. La ecuación de Goldman toma la distribución desigual de iones a través de la membrana celular y las diferencias en la permeabilidad de la membrana al determinar este potencial inverso. La ecuación es la siguiente:
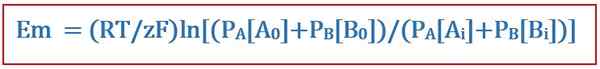
Dónde
- EM es la diferencia de potencial en la membrana celular,
- R es la constante de gas universal,
- T es la temperatura termodinámica,
- Z es el número de lunares de electrones que se están transfiriendo entre especies químicas,
- F es la constante de Faraday,
- PAGA o B es la permeabilidad de la membrana hacia A o B ion, y
- [A o B]i es la concentración de A o B ion dentro de la membrana celular.
¿Cuál es la diferencia entre la ecuación de Nernst y la ecuación de Goldman??
La ecuación nernst y la ecuación de Goldman son expresiones matemáticas que pueden usarse como mediciones del potencial de las células electroquímicas. La diferencia clave entre la ecuación de Nernst y la ecuación de Goldman es que la ecuación de Nernst describe la relación entre el potencial de reducción y el potencial de electrodo estándar, mientras que la ecuación de Goldman es un derivado de la ecuación de Nernst y describe el potencial de reversión a través de una membrana celular de la membrana celular.
La siguiente infografía resume la diferencia entre la ecuación de Nernst y la ecuación de Goldman.

Resumen -Ecuación de la ecuación Nernst vs Goldman
La ecuación nernst y la ecuación de Goldman son expresiones matemáticas que pueden usarse como mediciones del potencial de las células electroquímicas. La diferencia clave entre la ecuación de Nernst y la ecuación de Goldman es que la ecuación de Nernst describe la relación entre el potencial de reducción y el potencial de electrodo estándar, pero la ecuación de Goldman es un derivado de la ecuación de Nernst y describe el potencial de reversión a través de una membrana celular.
Referencia:
1. "Ecuación nernst."Bibliotecas de química, Librettexts, 5 de junio de 2019, disponible aquí.
Imagen de cortesía:
1. "Electrochemcell" de Alksub en la Wikipedia inglesa (CC By-SA 3.0) a través de Commons Wikimedia


