Diferencia entre el potencial nernst y el potencial zeta
El diferencia clave entre el potencial nernst y el potencial zeta es que El potencial nernst se da para una célula biológica o una célula electroquímica, mientras que el potencial zeta se da para una dispersión coloidal.
Nernst potencial y potencial zeta son términos en química física que describen la diferencia potencial entre algo, e.gramo. La membrana celular, la célula electroquímica, la membrana de una partícula dispersa en un medio de dispersión, etc.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el potencial nernst?
3. ¿Qué es el potencial de Zeta?
4. Comparación de lado a lado: potencial nernst vs potencial zeta en forma tabular
5. Resumen
¿Qué es el potencial nernst??
El potencial o el potencial de inversión nernst es el potencial en una membrana celular que se opone a la difusión neta de un ion particular a través de la membrana. Por lo tanto, este término tiene solicitudes en bioquímica. Podemos determinar el potencial nernst por la relación de las concentraciones de ese ion específico (que está tratando de pasar a través de la membrana celular) dentro de la célula y fuera de la célula. Sin embargo, este término también se usa en electroquímica, con respecto a las células electroquímicas. La ecuación que se utiliza para determinar el potencial nernst se llama ecuación nernst.
La ecuación nernst puede describirse como una expresión matemática que da la relación entre el potencial de reducción y el potencial de reducción estándar de una célula electroquímica. Esta ecuación lleva el nombre del científico Walther Nernst. Además, esta ecuación se desarrolló utilizando los otros factores que afectan la oxidación electroquímica y las reacciones de reducción, como la temperatura y la actividad química de las especies químicas que sufren oxidación y reducción.
Para obtener la ecuación de Nernst, debemos considerar los cambios estándar en la energía libre de Gibbs que está asociada con transformaciones electroquímicas que ocurren en la célula. La reacción de reducción de una célula electroquímica se puede administrar de la siguiente manera:
Buey+ z e- ⟶ rojo
En la termodinámica, el cambio real de energía libre de la reacción es,
E = Ereducción - mioxidación
Podemos relacionar la energía libre de Gibbs (ΔG) con la E (diferencia de potencial) de la siguiente manera:
ΔG = -NFE
Donde n es el número de electrones transferidos entre especies químicas cuando la reacción está progresando, F es la constante de Faraday. Si consideramos las condiciones estándar, entonces la ecuación es la siguiente:
ΔG0 = -Nfe0
Podemos relacionar la energía libre de Gibbs de las condiciones no estándar con la energía Gibbs de las condiciones estándar a través de la siguiente ecuación.
ΔG = ΔG0 + Rtlnq
Luego, podemos sustituir las ecuaciones anteriores en esta ecuación estándar para obtener la ecuación Nernst de la siguiente manera:
-nfe = -nfe0 + Rtlnq
Entonces la ecuación nernst es la siguiente:
E = E0 - (RTLNQ/NF)
¿Qué es el potencial de Zeta??
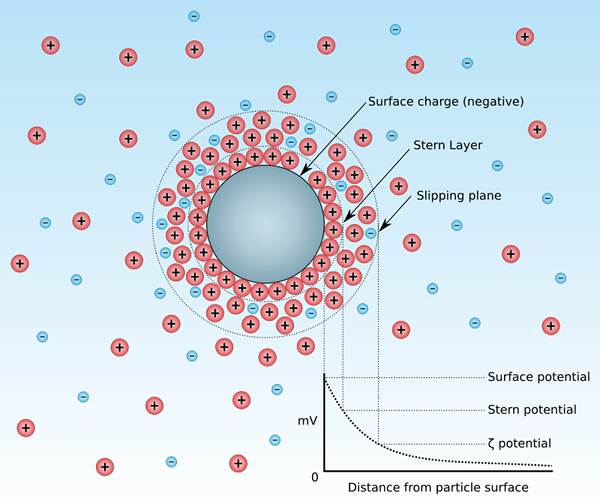
El potencial zeta es el potencial electrocinético de una dispersión coloidal. Este término proviene de la letra griega "Zeta". En general, llamamos a este potencial electroquinético potencial zeta. En otras palabras, el potencial zeta es la diferencia de potencial entre el medio de dispersión y la capa estacionaria del fluido unido a la partícula dispersa de la dispersión coloidal. Eso significa que el término potencial zeta nos da una indicación de la carga que está presente en la superficie de las partículas. Podemos reconocer dos tipos de potencial zeta: potencial zeta positivo y negativo. Además, este potencial es lo que medimos como la velocidad de las partículas en un D.C. campo eléctrico.

Figura 01: una partícula en una suspensión coloidal
Entre los dos tipos, el potencial zeta positivo indica que las partículas dispersas en la suspensión en la que medimos el potencial zeta tienen una carga positiva. Además, cuando estamos considerando los valores, no hay diferencias significativas entre el potencial zeta positivo y negativo.
Por otro lado, el potencial zeta negativo indica que las partículas dispersas en la suspensión en la que medimos el potencial zeta tienen una carga negativa; Por lo tanto, la carga de las partículas dispersas es negativa.
¿Cuál es la diferencia entre el potencial nernst y el potencial zeta??
El potencial nernst y el potencial zeta se utilizan en química física. La diferencia clave entre el potencial nernst y el potencial zeta es que se da el potencial de Nernst para una célula biológica o una célula electroquímica, mientras que el potencial zeta se da para una dispersión coloidal.
A continuación, la infografía muestra más diferencias entre el potencial nernst y el potencial zeta.
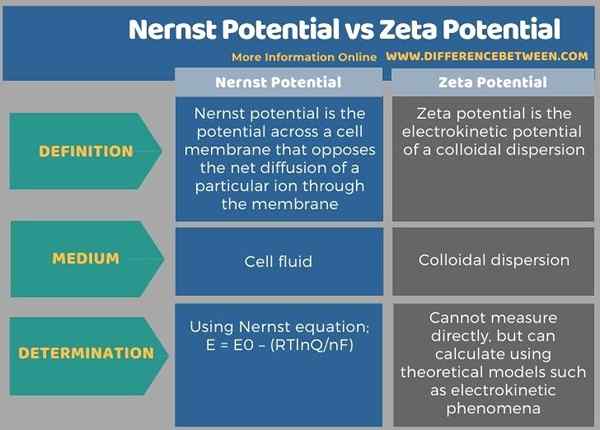
Resumen -potencial nernst vs zeta potencial
Los términos nernst potencial y potencial zeta se utilizan en química física. La diferencia clave entre el potencial nernst y el potencial zeta es que se da el potencial de Nernst para una célula biológica o una célula electroquímica, mientras que el potencial zeta se da para una dispersión coloidal.
Referencia:
1. "Potencial zeta."Wikipedia. 23 de junio de 2020, disponible aquí.
Imagen de cortesía:
1. "Diagrama del potencial zeta y deslizamiento de planev2" por modificado y convertido a SVG por MJONES1984. Trabajo original de Larryisgood. -(CC BY-SA 3.0) a través de Commons Wikimedia


