Diferencia entre nitrato y nitrito
El diferencia clave entre el nitrato y el nitrito es que El nitrato contiene tres átomos de oxígeno unidos a un átomo de nitrógeno, mientras que el nitrito contiene dos átomos de oxígeno unidos a un átomo de nitrógeno.
Tanto el nitrato como el nitrito son aniones inorgánicos que consisten en átomos de nitrógeno y oxígeno. Ambos aniones tienen una carga eléctrica -1. Se producen principalmente como el anión de los compuestos de sal. Hay algunas diferencias entre nitrato y nitrito; Estaremos discutiendo esas diferencias en este artículo.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es el nitrato
3. ¿Qué es el nitrito?
4. Comparación de lado a lado: nitrato vs nitrito en forma tabular
5. Resumen
Que es el nitrato??
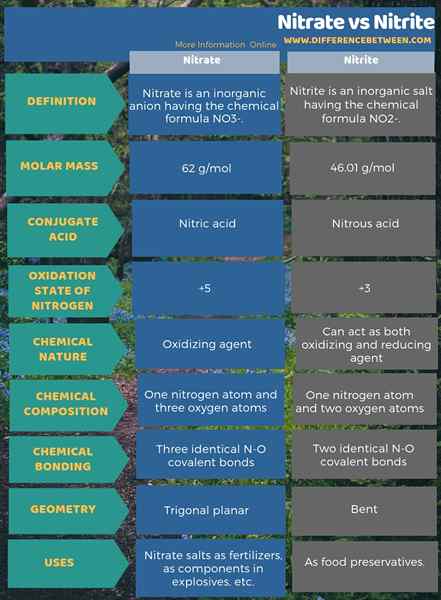
El nitrato es un anión inorgánico que tiene la fórmula química no3-. Es un anión poliatómico que tiene 4 átomos; un átomo de nitrógeno y tres átomos de oxígeno. El anión tiene -1 carga general. La masa molar de este anión es de 62 g/mol. Además, este anión se deriva de su ácido conjugado; ácido nítrico o HNO3. En otras palabras, el nitrato es la base conjugada del ácido nítrico.
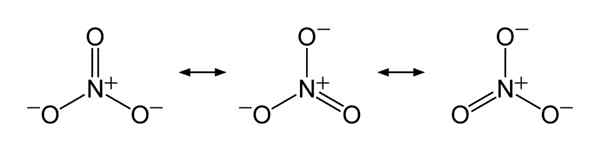
En resumen, el ion de nitrato tiene un átomo de nitrógeno en el centro que se une con tres átomos de oxígeno a través de un enlace químico covalente. Al considerar la estructura química de este anión, tiene tres enlaces N-O idénticos (de acuerdo con las estructuras de resonancia del anión). Por lo tanto, la geometría de la molécula es trigonal plana. Cada átomo de oxígeno lleva un 2⁄3 carga, que da la carga general del anión como -1.

Figura 01: Estructuras de resonancia del ion nitrato
A presión y temperatura estándar, casi todos los compuestos de sal que contienen este anión se disuelven en agua. Podemos encontrar sales de nitrato naturales en la tierra como depósitos; depósitos nitratina. Contiene principalmente nitrato de sodio. Además, las bacterias nitrificantes pueden producir iones de nitrato. Uno de los principales usos de las sales de nitrato está en la producción de fertilizantes. Además, es útil como agente oxidante en explosivos.
¿Qué es el nitrito??
El nitrito es una sal inorgánica que tiene la fórmula química no2-. Este anión es un anión simétrico, y tiene un átomo de nitrógeno unido a dos átomos de oxígeno con dos enlaces químicos covalentes n-o idénticos. Por lo tanto, el átomo de nitrógeno está en el centro de la molécula. El anión tiene -1 carga general.
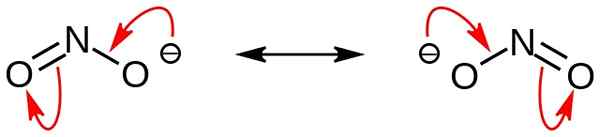
Figura 02: Estructuras de resonancia del ion de nitrito
La masa molar del anión es 46.01 g/mol. Además, este anión se deriva del ácido nitroso o HNO2. Por lo tanto, es la base conjugada del ácido nitroso. Por lo tanto, podemos producir sales de nitrito industrialmente mediante el paso de los humos nitrosos en la solución acuosa de hidróxido de sodio. Además, esto produce nitrito de sodio que podemos purificar a través de la recristalización. Además, las sales de nitrito, como el nitrito de sodio.
¿Cuál es la diferencia entre nitrato y nitrito??
El nitrato es un anión inorgánico que tiene la fórmula química no3- mientras que el nitrito es una sal inorgánica que tiene la fórmula química no2-. Por lo tanto, la diferencia principal entre nitrato y nitrito se encuentra en la composición química de los dos aniones. Eso es; La diferencia clave entre el nitrato y el nitrito es que el nitrato contiene tres átomos de oxígeno unidos a un átomo de nitrógeno, mientras que el nitrito contiene dos átomos de oxígeno unidos a un átomo de nitrógeno. Además, el ion de nitrato se deriva de su ácido conjugado; El ácido nítrico, mientras que el ion nitrito se deriva del ácido nitroso. Como otra diferencia importante entre el nitrato y los iones de nitrito, podemos decir que el nitrato es un agente oxidante porque puede sufrir la única reducción, mientras que el nitrito puede actuar como agente oxidante y reductor.
Resumen -Nitrato vs nitrito
El nitrato y el nitrito son aniones nitrogenados que ocurren principalmente como compuestos de sal. La diferencia clave entre el nitrato y el nitrito es que el nitrato contiene tres átomos de oxígeno unidos a un átomo de nitrógeno, mientras que el nitrito contiene dos átomos de oxígeno unidos a un átomo de nitrógeno.
Referencia:
1. "Nitrato."Wikipedia, Fundación Wikimedia, 6 de octubre. 2018. Disponible aquí
2. "Nitrito."Wikipedia, Fundación Wikimedia, 1 de noviembre. 2018. Disponible aquí
Imagen de cortesía:
1."Nitrato-ion-Resonance-2d" por Ben Mills-Trabajo propio, (dominio público) a través de Commons Wikimedia
2."Estructuras canónicas de iones de nitrito" de Nothingserious-PROPIO trabajo, (dominio público) a través de Commons Wikimedia


