Diferencia entre octet y duplet
Diferencia de clave - Octet vs Duplet
Hay átomos o compuestos químicamente activos e inactivos presentes en la naturaleza. Esta característica depende principalmente del número de electrones presentes en las cubiertas más externas de los átomos. Los átomos que tienen capas incompletas pueden volverse activas para completar su configuración de electrones para volverse estable. Los átomos que están inactivos tienen una configuración de electrones completa; Por lo tanto, estos átomos no reaccionan con ningún otro átomo a menos que en condiciones especiales. Los gases nobles siempre son de naturaleza inactiva. Por lo tanto, se conocen como gases inertes. Los gases inerte están en la octava columna en la tabla periódica. Otros elementos en el mismo período (fila) tienden a obtener la configuración de electrones del gas inerte al final de ese período, que es la forma más estable de la naturaleza. Los átomos activos tienden a completar el número de electrones según regla de octeto o regla duplet. La diferencia clave entre octet y duplet es que El octeto es un átomo o un ion que tiene un máximo de ocho electrones en la cubierta más externa mientras Duplet es un átomo que tiene el máximo de dos electrones en la cubierta más externa.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es un octeto
3. Que es un duplet
4. Comparación de lado a lado - Octet vs Duplet
5. Resumen
Que es un octeto?
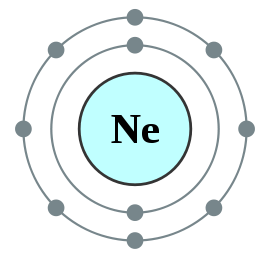
Un octeto es un átomo o un ion que tiene ocho electrones en la cubierta más externa de ese átomo. Todos los gases nobles excepto helio tienen ocho electrones y son inertes en la naturaleza. La configuración de electrones de un gas noble siempre terminará de la siguiente manera.
ns2 notario público6
Por ejemplo, la configuración electrónica de neón es 1s22S22P6 . El neón es un gas inerte.
Otros elementos que tienen siete, seis, etc. Los electrones en el orbital más externo tienden a obedecer la regla de los octetos al obtener electrones del exterior; Algunos otros elementos tienen uno, dos, etc. Los electrones tienden a perder electrones y obtienen la configuración de electrones del gas inerte más cercano. Pero otros elementos en el medio de la tabla periódica formarán nuevos enlaces con elementos que tienen exceso de electrones para compartir esos electrones y convertirse en un octeto.
Figura 01: Neon, un octeto
Que es un duplet?
El átomo de hidrógeno y el átomo de helio son los elementos más pequeños de la naturaleza y tienen un solo orbital alrededor de su núcleo. Este orbital se llama orbital 1. Este orbital puede contener un máximo de dos electrones. El átomo de hidrógeno tiene un electrón y el helio tiene dos electrones. Por lo tanto, Helium se llama Duplet. El helio tiene el número máximo de electrones que puede tener; Por lo tanto, es un elemento estable en la naturaleza. Por lo tanto, el helio también es un gas inerte. Pero el hidrógeno tiene solo un electrón y el único orbital que tiene es incompleto. Por lo tanto, el átomo de hidrógeno solo es muy reactivo y tiende a formar un enlace covalente con otro átomo de hidrógeno compartiendo los únicos electrones que tienen. Entonces estos átomos de hidrógeno se convierten en duplets, ya que ahora tienen dos electrones en sus orbitales más externos. Pero el litio también puede comportarse como un duplete al eliminar el electrón de su orbital más externo. La configuración electrónica de litio es 1s22S1. Eliminando los 2s1 Electron, puede convertirse en un duplet. En ese caso, él, h- y li+ son duplets que pueden existir como duplets estables.
Todos los duplets tienen la configuración de electrones que termina de la siguiente manera.
ns2

Figura 02: helio, un duplet
¿Cuál es la diferencia entre octet y duplet??
Octeto vs Duplet | |
| El octeto tiene ocho electrones en la carcasa más externa. | Duplet tiene dos electrones en la carcasa más externa. |
| Configuración de electrones | |
| El octeto tiene NS2 notario público6 Tipo de configuración de electrones al final. | Duplet tiene ns2 Escriba la configuración al final. |
| Número de orbitales | |
| El octeto puede tener un mínimo de dos orbitales. | Un duplet tiene solo un orbital. |
| Tipo de orbitales | |
| Un octeto puede tener todo tipo de orbitales como S, P, D, F, etc. | Duplet solo tiene s orbital. |
Resumen - Octet vs Duplet
Todos los elementos tienden a ser estables. Pero con configuraciones de electrones incompletas, los átomos no pueden ser estables; Por lo tanto, se vuelven muy reactivos para llenar las cáscaras con electrones ganando, perdiendo o compartiendo electrones. Los átomos o moléculas que obedecen la regla del octeto o el duplete son estables. La diferencia clave entre Octet y Duplet es que Octet tiene ocho electrones en su orbital más externo, mientras que Duplet tiene dos electrones en su orbital.
Referencias:
1. Nema, P., 2011. Topperlearning. [En línea] disponible en: http: // www.topperlearning.com/foros/home-work-help-19/what-is-octet-duplet-valentency-y-ions-quemistry-estructura-de-atom-46317/respuesta [consultado el 29 05 2017].
2.Chang, R., 2010. Química. 10ª ed. Nueva York: McGraw-Hill.
3.Luego., 2015. Apilador de calificaciones. [En línea] Disponible en: http: // Gradestack.COM/NTSE-COMPLETE-COURSE/Bonding químico/Actividad química-AN/19176-3853-37737-Study-WTW [Consultado el 29 05 2017].
Imagen de cortesía:
1. "Electron Shell 002 Helium - No etiqueta" de Pumbaa (trabajo original de Greg Robson) - Diagramas de Shell Electron (versión etiquetada correspondiente) (CC BY -SA 2.0 Reino Unido) Vía Commons Wikimedia
2. "Electron Shell 010 Neon" de Pumbaa (trabajo original de Greg Robson) (CC By-SA 2.0 Reino Unido) Vía Commons Wikimedia


