Diferencia entre el diagrama orbital y la configuración de electrones
El diferencia clave entre el diagrama orbital y la configuración de electrones es que El diagrama orbital muestra los electrones en las flechas, lo que indica el giro de los electrones. Pero, la configuración de electrones no muestra detalles sobre el giro de los electrones.
El diagrama orbital muestra la disposición de los electrones dados por la configuración de electrones. La configuración electrónica proporciona los detalles sobre la distribución de los electrones a lo largo de los orbitales del átomo. Pero, el diagrama orbital también muestra el giro de los electrones. Esta es la diferencia básica entre el diagrama orbital y la configuración de electrones.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el diagrama orbital?
3. ¿Qué es la configuración de electrones?
4. Comparación de lado a lado: diagrama orbital vs configuración electrónica en forma tabular
6. Resumen
¿Qué es el diagrama orbital??
El diagrama orbital es un tipo de diagrama que muestra la distribución de electrones en los orbitales de un átomo e indica el giro de esos electrones. Es un tipo de notación que muestra qué orbitales se llenan y cuáles se llenan parcialmente. Aquí, usamos flechas para representar electrones. La dirección de la punta de flecha (hacia arriba o hacia abajo) indica el giro del electrón.
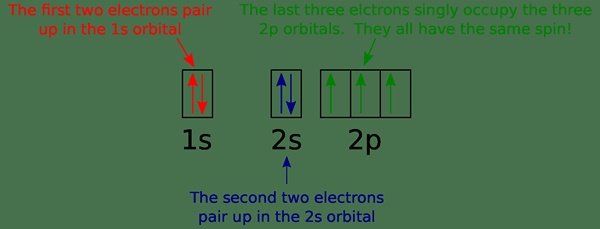
Figura 01: Diagrama orbital para nitrógeno
Un orbital puede tener un máximo de dos electrones. Según el principio de exclusión de Pauli, dos electrones en el mismo átomo no pueden tener el mismo conjunto de números cuánticos. Esto significa que, incluso si todos los demás números cuánticos son los mismos, el número cuántico de giro es diferente. Los dos electrones en el mismo orbital tienen un giro opuesto. La imagen de arriba muestra un ejemplo de un diagrama orbital.
¿Qué es la configuración de electrones??
La configuración de electrones es una forma de organizar los electrones de un átomo al mostrar la distribución de esos electrones en todas las orbitales. Anteriormente, la configuración de electrones se desarrolló utilizando el modelo BOHR del átomo. Esto es exacto para átomos pequeños con menos electrones, pero al considerar grandes átomos con una gran cantidad de electrones, tenemos que usar la teoría cuántica para la determinación de la distribución de electrones.
Según la mecánica cuántica, una carcasa de electrones es el estado de varios electrones que comparten el mismo número cuántico principal, y nombramos el caparazón utilizando el número dado para el nivel de energía y el tipo de orbital que estamos considerando, e.gramo., 2s se refiere al orbital S de la cubierta de electrones del segundo nivel de energía. Además, hay un patrón que describe el número máximo de electrones que puede contener una cubierta de electrones. Aquí, este número máximo depende del número cuántico azimutal, L. Además, los valores l = 0, 1, 2 y 3 se refieren a los orbitales S, P, D y F respectivamente. El número máximo de electrones que una carcasa puede contener = 2 (2l+1). Por lo tanto, podemos desarrollar la siguiente tabla;
| Orbital | Número máximo de electrones 2 (2L+1) |
| L = 0 es s orbital | 2 |
| L = 1 es P orbital | 6 |
| L = 2 es d orbital | 10 |
| L = 3 es para orbital | 14 |

Al considerar la notación de la configuración de electrones, necesitamos usar la secuencia de números cuánticos. Por ejemplo, la configuración de electrones para el átomo de hidrógeno es 1s1. Aquí, esta notación dice que los átomos de hidrógeno tienen un electrón en el orbital S de la primera carcasa de electrones. Para el fósforo, la configuración de electrones es 1s22S22P63S23P3. Eso significa; El átomo de fósforo tiene 3 conchas de electrones llenas de 15 electrones.
¿Cuál es la diferencia entre el diagrama orbital y la configuración de electrones??
El diagrama orbital muestra la disposición de los electrones dados por la configuración de electrones. La diferencia clave entre el diagrama orbital y la configuración de electrones es que el diagrama orbital muestra los electrones en las flechas que indican el giro de los electrones. Mientras tanto, la configuración de electrones no muestra detalles sobre el giro de los electrones. Además, en el patrón de notación, los diagramas orbitales usan flechas para representar electrones, mientras que la configuración de electrones indica electrones utilizando números.
A continuación se muestra un resumen de la diferencia entre el diagrama orbital y la configuración de electrones.
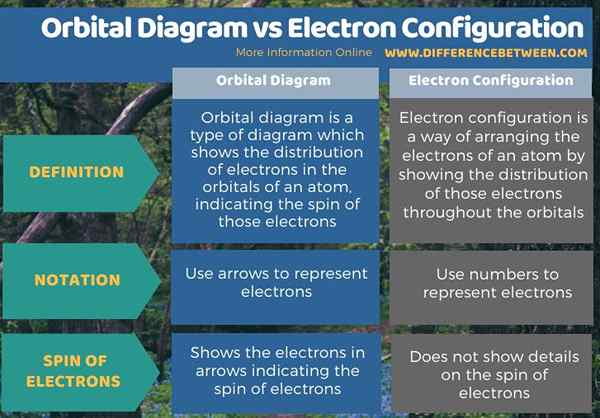
Resumen -Diagrama orbital frente a la configuración de electrones
La diferencia clave entre el diagrama orbital y la configuración de electrones es que el diagrama orbital muestra los electrones en flechas que indican el giro de los electrones, mientras que la configuración de electrones no muestra detalles sobre el giro de los electrones.
Referencia:
1. "1.4: Configuración de electrones y diagramas orbitales."Bibliotecas de química, Librettexts, 26 de septiembre. 2019, disponible aquí.
Imagen de cortesía:
1. "Diagrama orbital de nitrógeno" de la Fundación CK -12 (Raster), Adrignola (Vector) - Archivo: Química de la escuela secundaria.PDF, página 327 (dominio público) a través de Commons Wikimedia
2. "Orbitales de electrones" de Patricia.Fidi - Trabajo propio de Patricia.Fidi y Lt Paul - Originario de PL: Grafika: Orbitale.PNG, autor PL: Wikipedysta: Chemmix.Esta imagen vectorial no especificada W3C se creó con Inkscape (dominio público) a través de Commons Wikimedia


