Diferencia entre el orden de reacción y la molecularidad
Diferencia clave: orden de reacción vs molecularidad
Las reacciones químicas son cambios que ocurren en los compuestos químicos. Conduce a la conversión de una sustancia química a otra. Los compuestos iniciales que sufren la reacción química se denominan reactivos. Lo que obtenemos al finalizar la reacción son los productos. El orden de la reacción se da con respecto a una sustancia; puede ser con respecto a un reactivo, producto o catalizador. El orden de reacción con respecto a una sustancia es el exponente al que se eleva su concentración en la ecuación de velocidad. La molecularidad de las reacciones químicas expresa cuánto están involucradas las moléculas reactivas en la reacción. La diferencia clave entre el orden de reacción y la molecularidad es que El orden de reacción da la relación entre la concentración de una especie química y la reacción que sufre, mientras que la molecularidad indica cuántas moléculas reactivas están involucradas en la reacción.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Cuál es el orden de reacción?
3. ¿Qué es la molecularidad?
4. Comparación de lado a lado: orden de reacción frente a molecularidad en forma tabular
5. Resumen
¿Cuál es el orden de reacción?
El orden de reacción con respecto a una sustancia es el exponente al que se eleva su concentración en la ecuación de velocidad. Para comprender este concepto, primero debemos saber qué es la ley de tasas.
Ley de calificaciones
La ley de velocidad indica que la velocidad de la progresión de una reacción química (a temperatura constante) es proporcional a las concentraciones de reactivos elevados a los exponentes que se determinan experimentalmente. Estos exponentes se conocen como órdenes de esas concentraciones. Consideremos un ejemplo.
2n2O5 ↔ 4 No2 + O2
Para la reacción anterior, la ecuación de la ley de velocidad se proporciona a continuación.
Tasa = k.[NORTE2O5]X
En la ecuación anterior, K es la constante de proporcionalidad que se conoce como la constante de la tasa. Es una constante a temperatura constante. Los soportes se utilizan para expresar que es la concentración del reactante. El símbolo X es el orden de la reacción con respecto al reactante. El valor de x debe determinarse experimentalmente. Para esta reacción, se ha encontrado que x = 1. Aquí, podemos ver que el orden de reacción no es igual a la estequiometría de la reacción. Pero en algunas reacciones, el orden de reacción puede ser igual a la estequiometría.
Para una reacción que tiene dos o más reactivos, el ecuación de ley de tasas se puede escribir como se muestra a continuación.
A+ B+ C ↔ P
Tasa = k.[A]a[B]b[C]C
A, B y C son órdenes de la reacción con respecto a los reactivos A, B y C, respectivamente. Para este tipo de ecuaciones de velocidad (con varias órdenes de reacción), la suma de las órdenes de reacción se da como el orden general de reacción.
Orden general = a + b + c

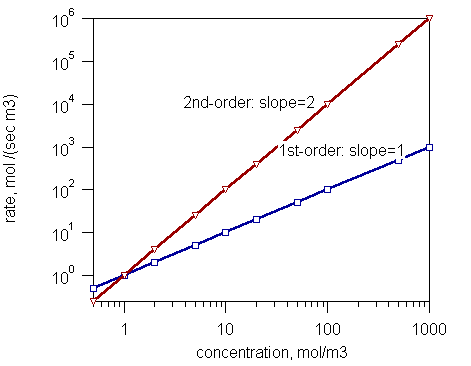
Figura 1: Tasa de reacciones de primer orden y segundo orden
Según el orden de reacción, hay varios tipos de reacciones:
- Reacciones de orden cero (El orden de reacción es cero con respecto a cualquier reactivo utilizado. Por lo tanto, la velocidad de reacción no depende de las concentraciones de los reactivos utilizados.)
- Reacciones de primer orden (La velocidad es proporcional a la concentración de un reactante)
- Reacciones de segundo orden (La velocidad de reacción es proporcional al cuadrado de la concentración de un reactivo o al producto de concentraciones de dos reactivos)
¿Qué es la molecularidad?
La molecularidad de una reacción es el número de moléculas o iones que participan en una reacción como reactivos. Más importante aún, los reactivos considerados son los que participan en el paso de determinación de la velocidad de la reacción general. El paso de determinación de la velocidad de una reacción es el paso más lento de la reacción general. Esto se debe a que el paso de reacción más lento determina la velocidad de reacción.
Figura 2: una reacción unimolecular
La molecularidad puede ser de diferentes tipos:
- Las reacciones unimoleculares tienen una molécula reactiva (o ion)
- Las reacciones bimoleculares tienen dos reactivos (dos reactivos pueden ser del mismo compuesto o compuestos diferentes)
- Las reacciones trimoleculares tienen tres reactivos.
¿Cuál es la diferencia entre el orden de reacción y la molecularidad??
Orden de reacción vs molecularidad | |
| El orden de la reacción con respecto a una sustancia es el exponente al que se eleva su concentración en la ecuación de velocidad. | La molecularidad de una reacción es el número de moléculas o iones que participan en una reacción como reactivos. |
| Relación con los reactivos | |
| El orden de reacción explica cómo la concentración de reactivos afecta la velocidad de reacción. | La molecularidad da el número de reactivos que participan en una reacción. |
Resumen - Orden de reacción vs molecularidad
La ley de velocidad indica que la tasa de progresión de una reacción química (a temperatura constante) es proporcional a las concentraciones de reactivos elevados a los exponentes que se determinan experimentalmente. El orden de reacción se da con respecto a un reactivo. Explica la dependencia de la velocidad de reacción de las concentraciones de reactivos. La diferencia clave entre el orden de reacción y la molecularidad es que el orden de reacción da la relación entre la concentración de una especie química y la reacción que experimenta, mientras que la molecularidad expresa cuántas moléculas reactivas están involucradas en la reacción.
Referencia:
1. "La ley de tasas."Bibliotecas de química, Librettexts, 21 de julio de 2016, disponible aquí.
2. "Orden de reacción."Bibliotecas de química, Librettexts, 21 de julio de 2016, disponible aquí.
3. "Molecularidad y cinética."Bibliotecas de química, Librettexts, 21 de julio de 2016, disponible aquí.
Imagen de cortesía:
1. "Rateloglogplot" de Fabiuccio ~ enwikibooks en English Wikibooks - Transferido desde EN.wikibooks a los comunes., (Dominio público) a través de Commons Wikimedia
2. "Cis-trans-stilbene" de Pancrat-Trabajo propio (CC By-SA 3.0) a través de Commons Wikimedia


