Diferencia entre el número de oxidación y el cargo
El diferencia clave entre el número de oxidación y la carga es que Podemos determinar el número de oxidación de un átomo considerando el número de electrones que se elimina o se obtiene por ese átomo, mientras que la carga se determina considerando el número total de electrones y protones en el átomo.
Diferentes elementos en la tabla periódica exhiben diferentes características químicas y físicas. Y cuando se unen para formar moléculas, diferentes elementos se unen con otros elementos en diferentes proporciones. Entre una gran cantidad de variaciones entre elementos, los parámetros más simples e importantes son su número de carga y oxidación. La carga y el número de oxidación de un elemento ayudan a identificar, a qué grupo este elemento pertenece a la tabla periódica. Lo más importante, es útil describir la capacidad del elemento para formar otras moléculas y compuestos de coordinación y, por lo tanto, ayuda a identificar sus fórmulas empíricas.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el número de oxidación?
3. Que es el cargo
4. Comparación de lado a lado: número de oxidación frente a carga en forma tabular
5. Resumen
¿Qué es el número de oxidación??
El número de oxidación es una característica del átomo central de un compuesto de coordinación. Es la carga del átomo central de un compuesto de coordinación cuando todos los enlaces alrededor de este átomo son enlaces iónicos. Por lo tanto, a veces la carga y el número de oxidación son similares, pero a veces es diferente. Por ejemplo, los elementos simples del bloque S y el bloque P tienen el mismo número de oxidación que su carga. Además, los iones poliatómicos tienen el mismo número de oxidación que la carga. Sin embargo, el mismo elemento químico puede tener diferentes números de oxidación, dependiendo de los otros átomos a su alrededor. En un elemento libre, el número de oxidación siempre es cero. Además, los iones metálicos de transición (bloqueo D) y los elementos tienen diferentes números de oxidación.
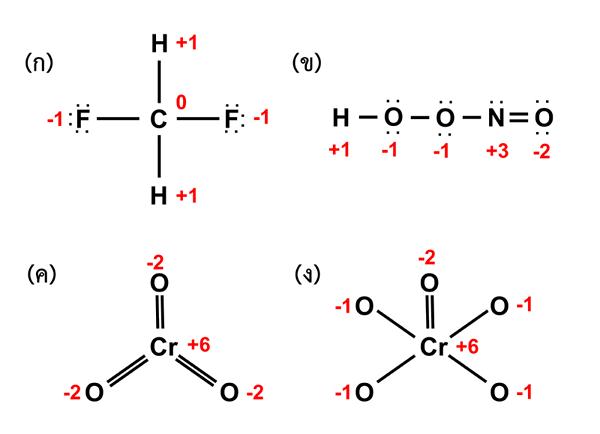
Figura 01: Determinación de los números de oxidación de diferentes elementos en compuestos
Al considerar un compuesto de coordinación, el átomo de metal central siempre debe tener orbitales vacíos a los cuales los ligandos donan sus pares de electrones solitarios y forman enlaces iónicos. Además, podemos denotar el número de oxidación del átomo de metal central con números romanos dentro de los soportes. Por ejemplo, si el número de oxidación de metal "M" es 3, entonces lo escribimos como M (iii).
Que es el cargo?
La carga de cualquier átomo es cero. Cuando los átomos eliminan o ganan electrones, obtienen una carga eléctrica. Esto se debe a que los electrones son partículas subatómicas cargadas negativamente, mientras que los protones se cargan positivamente. Los átomos realizan la eliminación o la obtención de electrones para llenar su carcasa de valencia de acuerdo con la regla del octeto.
En un átomo, el número de protones y electrones es igual. Dado que los protones tienen una carga positiva y los electrones tienen una carga negativa, cuando los electrones de la cubierta de valencia se eliminan, el átomo forma un ion cargado positivamente, porque el número de protones positivos es mayor que el número de electrones en ese ion.
Determinación de la carga
Además, cuando un átomo es más electronegativo, puede atraer electrones de otros átomos hacia sí mismo. Allí, ganan más electrones que el número de protones reside en su núcleo. Por lo tanto, los átomos se convierten en iones negativos. Además, el número de electrones donados o abstractos difiere del átomo al átomo. Podemos predecir esto desde la posición del elemento en la tabla periódica. Por lo general, los mismos átomos grupales formarán los mismos iones cargados, porque tienen el mismo número de electrones de valencia.

Figura 02: Estructura de un átomo para determinar la carga
El número de grupo también muestra el número de electrones de valencia; Por lo tanto, podemos determinar la carga de los iones formados por los átomos en ese grupo. Por ejemplo, los elementos del grupo uno forman iones monovalentes con +1 carga eléctrica. Grupo dos elementos forman iones divalentes cargados positivamente. Los átomos del grupo tres y del grupo cuatro forman +3 y +4 iones cargados en consecuencia. Desde el grupo cinco hasta el grupo siete, los átomos hacen iones cargados negativamente, porque es más fácil llenar sus electrones de valencia al obtener 2 o 3 electrones en lugar de emitir cinco, seis o siete electrones. Por lo tanto, el grupo cinco elementos realizan iones cargados -3, mientras que los elementos del Grupo 6 hacen -2 iones y elementos del grupo 7 hacen -1 iones. Aparte de estos iones simplemente cargados, también hay iones complejos con cargos como NH4+ y compañía32-etc.
¿Cuál es la diferencia entre el número de oxidación y la carga??
El número de oxidación y el cargo son dos términos relacionados en química. Sin embargo, hay algunas diferencias entre el número de oxidación y la carga. La diferencia clave entre el número de oxidación y la carga es que podemos determinar el número de oxidación de un átomo considerando el número de electrones que se elimina o se obtiene por ese átomo, mientras que la carga se determina considerando el número total de electrones y protones en el átomo.
Además, puede haber varios números de oxidación para el mismo elemento químico dependiendo de los átomos que lo rodean, mientras que la carga del átomo es variable solo dependiendo del número de electrones y protones en el átomo. Por lo tanto, esta es otra diferencia importante entre el número de oxidación y la carga.

Resumen -Número de oxidación versus carga
La carga y el número de oxidación son dos términos relacionados. La diferencia clave entre el número de oxidación y la carga es que podemos determinar el número de oxidación de un átomo considerando el número de electrones que se eliminan o obtienen por ese átomo, mientras que la carga se determina considerando el número total de electrones y protones en el átomo.
Referencia:
1. "Número de oxidación." Metales de transición. Disponible aquí
2. Bibliotecas. "El átomo."Bibliotecas de química, National Science Foundation, 26 de noviembre. 2018. Disponible aquí
Imagen de cortesía:
1."Asignaciones de estado de oxidación" de Saranphong Yimklan - Trabajo propio, (dominio público) a través de Commons Wikimedia
2."Carga nuclear efectiva" por trabajo propio: carga nuclear efectiva.GIF, (dominio público) a través de Commons Wikimedia


