Diferencia entre electrones emparejados y no apareados
Los electrones emparejados en un átomo ocurren como pares en un orbital pero, los electrones no apareados no ocurren como pares de electrones o parejas. El diferencia clave entre electrones emparejados y no apareados es que el Los electrones emparejados causan diamagnetismo de átomos, mientras que los electrones no apareados causan paramagnetismo o ferromagnetismo en los átomos.
Los electrones son partículas subatómicas en átomos. Cada átomo contiene al menos un electrón. En el estado neutro de un átomo, el número de electrones es igual al número de protones en el núcleo atómico. Pero cuando tiene una carga eléctrica, estos números son desiguales (que causan la carga eléctrica). Podemos escribir la configuración de electrones para un átomo; Da la disposición de electrones en diferentes niveles de energía. Esta configuración de electrones revela sobre los electrones emparejados y no apareados en un átomo. Ahora discutamos cuáles son estas dos formas.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son electrones emparejados?
3. ¿Qué son los electrones no emparejados?
4. Comparación de lado a lado: electrones vs no apareados en forma tabular
5. Resumen
¿Qué son electrones emparejados??
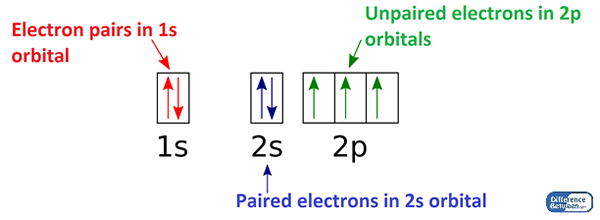
Los electrones emparejados son los electrones en un átomo que ocurren en un orbital como pares. Un orbital es la ubicación de un electrón en un átomo; En lugar de una ubicación específica, le da a la región donde un electrón se mueve alrededor del átomo porque los electrones están en movimiento continuo alrededor del núcleo atómico. Según las teorías modernas, los electrones existen en orbitales. Un orbital más simple puede contener un máximo de dos electrones. Cuando hay dos electrones en un orbital, decimos que hay un par de electrones. Estos son el electrón emparejado en un átomo. Algunos elementos químicos que tienen todos sus electrones emparejados son muy estables. Pero algunos son reactivos. La estabilidad depende de la configuración electrónica del átomo.

Figura 01: Disposición de electrones en los orbitales del átomo de nitrógeno
Además, si consideramos las propiedades magnéticas de un elemento químico, puede haber tres tipos principales de magnetismo como elementos diamagnéticos, paramagnéticos y ferromagnéticos. Este magnetismo depende principalmente de la cantidad de electrones no apareados. Por lo tanto, los electrones emparejados no tienen contribución al magnetismo. Luego podemos nombrar los elementos químicos que tienen todos sus electrones emparejados como elementos químicos diamagnéticos; El diamagnetismo significa que no atrae a un campo magnético.
¿Qué son los electrones no emparejados??
Los electrones no apareados son los electrones en un átomo que ocurren solo en un orbital. Esto significa que estos electrones no están emparejados ni ocurren como parejas de electrones. Podemos determinar fácilmente si hay electrones no apareados en un átomo simplemente escribiendo su configuración de electrones. Los átomos que tienen estos electrones muestran propiedades paramagnéticas o propiedades ferromagnéticas.
Los materiales paramagnéticos tienen pocos electrones no apareados, mientras que los materiales ferromagnéticos tienen más electrones no apareados; Por lo tanto, los materiales ferromagnéticos atraen a un campo magnético en un grado más alto que el de un material paramagnético. Cuando un átomo o una molécula tiene este tipo de electrón, lo llamamos radical libre. Los elementos químicos que tienen estos electrones son altamente reactivos. Esto se debe a que tienden a emparejar todos sus electrones para ser estables; Tener un electrón no apareado es inestable.
¿Cuál es la diferencia entre electrones emparejados y no apareados??
Los electrones emparejados son los electrones en un átomo que ocurren en un orbital como pares, mientras que los electrones no apareados son los electrones en un átomo que ocurren solo en un orbital. Por lo tanto, los electrones emparejados siempre ocurren como un par de electrones, mientras que los electrones no apareados ocurren como electrones individuales en el orbital. Esta es la diferencia fundamental entre los electrones emparejados y no apareados. Además, los electrones emparejados causan el diamagnetismo de los átomos, mientras que los electrones no apareados causan paramagnetismo o ferromagnetismo en átomos. Podemos decir esto como la diferencia clave entre los electrones emparejados y no apareados.
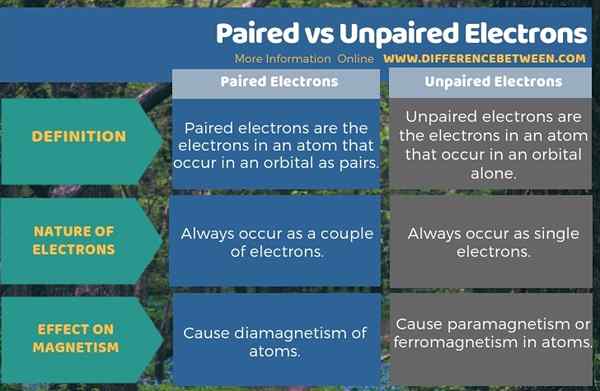
Resumen: electrones emparejados vs no apareados
Los electrones ocurren en orbitales atómicos. Están en libre movimiento alrededor del núcleo atómico. Estos electrones pueden ocurrir en dos tipos como electrones emparejados o no apareados. La diferencia entre los electrones emparejados y no apareados es que los electrones emparejados causan el diamagnetismo de los átomos, mientras que los electrones no apareados causan el paramagnetismo o el ferromagnetismo en los átomos.
Referencia:
1. "Electron no apareado."Wikipedia, Fundación Wikimedia, 3 de julio de 2018. Disponible aquí


