Diferencia entre la abundancia por ciento y la abundancia relativa
Diferencia clave: porcentaje de abundancia versus abundancia relativa
Porcentaje de abundancia y abundancia relativa son valores porcentuales de elementos químicos que representan su ocurrencia en el medio ambiente. La diferencia clave entre el porcentaje de abundancia y la abundancia relativa es que El porcentaje de abundancia da la abundancia de isótopos, mientras que la abundancia relativa da la abundancia de elementos químicos. El porcentaje de abundancia se puede utilizar para determinar la masa atómica promedio de un cierto elemento químico. La abundancia relativa da la aparición de un cierto elemento químico en un entorno determinado, yo.E, en la tierra.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Cuál es el porcentaje de abundancia?
3. ¿Qué es la abundancia relativa?
4. Similitudes entre la abundancia porcentual y la abundancia relativa
5. Comparación de lado a lado -porcentaje de abundancia vs abundancia relativa en forma tabular
6. Resumen
¿Cuál es el porcentaje de abundancia??
Porcentaje de abundancia es el porcentaje de todos los isótopos naturales de un elemento. Los isótopos son átomos del mismo elemento que tienen números atómicos idénticos pero diferentes números de masa. Esto significa que los isótopos son átomos que tienen el mismo número de protones en el núcleo atómico, pero diferentes números de neutrones.
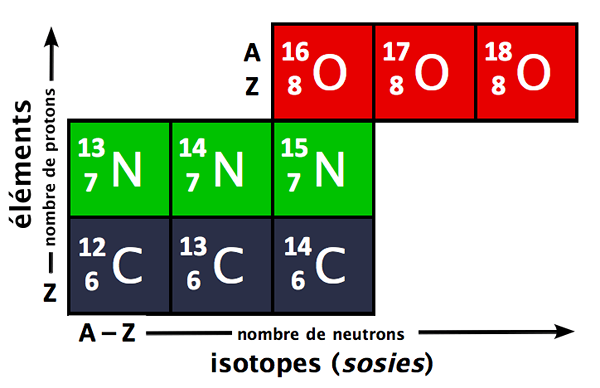
Figura 1: Se pueden usar isótopos de diferentes elementos para encontrar sus masas atómicas promedio
Los isótopos de cada elemento ocurren naturalmente en diferentes proporciones. El porcentaje de abundancia de un isótopo indica la probabilidad de encontrar esa naturaleza de isótopos, ya que los elementos se pueden encontrar como una mezcla de isótopos. El porcentaje de abundancia se puede usar para encontrar la masa atómica del elemento. La masa atómica se puede encontrar utilizando la siguiente ecuación.
Masa atómica promedio = ∑ (masa de isótopos x abundancia de isótopos)
Consideremos un ejemplo para entender esto. Los isótopos de cloro más estables y naturales son CL-35 (masa = 34.969 y porcentaje de abundancia = 75.53%) y CL-37 (masa = 36.966 y porcentaje de abundancia = 24.47%). Entonces,
La masa promedio de cloro = ∑ (masa de isótopo x por ciento de abundancia de isótopos)
= ∑ (34.969 x 75.53/100) + (36.966 x 24.47/100)
= 26.412 amu + 9.045 amu
= 35.46 amu.
¿Qué es la abundancia relativa??
La abundancia relativa de un elemento es una medida de la aparición de un elemento en relación con todos los demás elementos en el medio ambiente. Hay tres formas de determinar la abundancia relativa de un elemento:
- Fracción de masa
- Fracción molar
- Fracción de volumen
El método de fracción de volumen es más común para los elementos gaseosos en las mezclas de gas, i.e, la atmósfera de la tierra. Sin embargo, la mayoría de las expresiones de abundancia relativa son fracciones de masa.

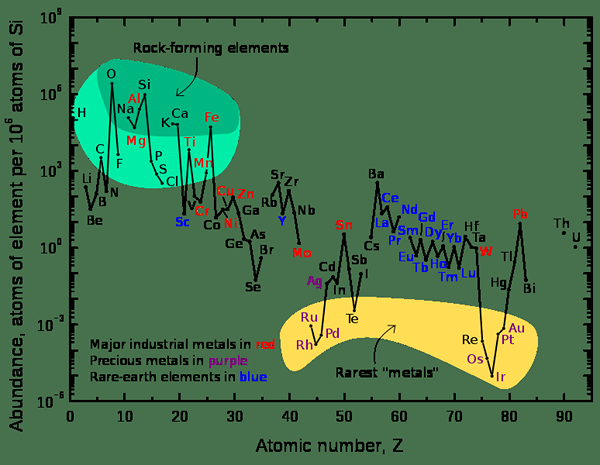
Figura 2: Un gráfico que muestra la abundancia relativa de elementos en la corteza superior de la Tierra
Al considerar el universo, los elementos químicos más abundantes son el hidrógeno y el helio. Al considerar la tierra, el elemento más común es el hierro cuyo porcentaje de masa es 32.1%. Otros elementos son oxígeno (32.1%), silicona (15.1%), magnesio (13.9%), azufre (2.9%) y otros elementos están presentes en porcentajes de trazas.
¿Cuáles son las similitudes entre la abundancia porcentual y la abundancia relativa??
- Tanto el porcentaje de abundancia como la abundancia relativa son valores porcentuales.
- Tanto el porcentaje de abundancia como la abundancia relativa expresan los porcentajes de diferentes elementos químicos.
¿Cuál es la diferencia entre la abundancia por ciento y la abundancia relativa??
Porcentaje de abundancia vs abundancia relativa | |
| Porcentaje de abundancia es el porcentaje de todos los isótopos naturales de un elemento. | La abundancia relativa de un elemento es un porcentaje de la aparición de un elemento en relación con todos los demás elementos en el medio ambiente. |
| Representación | |
| El porcentaje de abundancia da la abundancia de isótopos. | La abundancia relativa da la abundancia de elementos químicos. |
Resumen -porcentaje de abundancia versus abundancia relativa
Porcentaje de abundancia y abundancia relativa son dos términos utilizados para dar la abundancia de isótopos y elementos químicos. La diferencia clave entre la abundancia porcentual y la abundancia relativa es que la abundancia porcentual da la abundancia de isótopos, mientras que la abundancia relativa da la abundancia de elementos químicos.
Referencia:
1. "Misa atómica promedio."Masa atómica promedio, [correo electrónico protegido], disponible aquí.
2. "Abundancia de los elementos químicos."Wikipedia, Fundación Wikimedia, 25 de febrero. 2018, disponible aquí.
3. Simoes, Christian. "Abundancia de los elementos químicos."Astrono, disponible aquí.
Imagen de cortesía:
1. "Isótopo CNO" de Lucquessoy - Trabajo propio (CC By -Sa 3.0) a través de Commons Wikimedia
2. "Abundancias elementales" de Gordon B. Haxel, Sara Boore y Susan Mayfield de USGS; Vectorizado por el usuario: Michbich - (dominio público) a través de Commons Wikimedia


