Diferencia entre el diagrama de fase y el diagrama de equilibrio
Diferencia de clave: diagrama de fase vs diagrama de equilibrio
Los diagramas de fase o los diagramas de equilibrio son gráficos o gráficos que muestran la relación entre la temperatura, la presión y la composición de cualquier sistema. Estos diagramas dan detalles sobre condiciones de fases termodinámicamente distintas que coexisten en equilibrio entre sí. Una fase es una porción homogénea de un sistema que tiene propiedades químicas y físicas uniformes. Hay tres fases principales que puede existir una sustancia: fase sólida, líquida y gaseosa. No hay diferencia entre el diagrama de fase y el diagrama de equilibrio.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es un diagrama de fase?
3. ¿Qué es un diagrama de equilibrio?
4. Diagrama de fase vs diagrama de equilibrio
5. Resumen
¿Qué es un diagrama de fase??
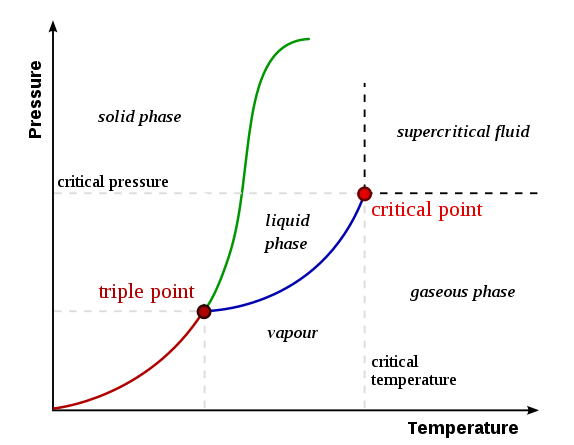
Un diagrama de fase es un cuadro que resume los detalles sobre las condiciones de los sistemas termodinámicamente distintos que coexisten en equilibrio entre sí. Un diagrama de fase muestra límites de fase o límites de equilibrio que separan las fases entre sí. El diagrama de fase es una gráfica de presión frente a temperatura.

Figura 1: Un diagrama de fase que muestra líneas límite, punto triple y punto crítico
Componentes importantes de un diagrama de fase
Algunos componentes importantes en un diagrama de fase incluyen seguidores:
- Límites de fase (límites de equilibrio): las líneas en un diagrama de fase que separan dos fases; cada fase que está en equilibrio con otra fase.
- Triple punto - un punto en el que la línea de equilibrio se cruza. Un punto triple indica las condiciones de un sistema que tiene una sustancia que puede coexistir en las tres fases de la materia (sólido, líquido y gas).
- Punto crítico - la temperatura y la presión a la que esa sustancia puede comportarse como un gas y un líquido al mismo tiempo; Se producen fases de gases y líquidos indistinguibles. Por lo tanto, no hay límites de fase. El punto crítico es el punto final de la curva en la fase
- Curva de fusión (Curvas de fusión o congelación): la línea límite en un diagrama de fase que muestra las condiciones para las transiciones de fase entre la fase gaseosa y la fase líquida (línea de color azul en el diagrama anterior).
- Curva de vaporización (o curva de condensación): la línea límite en un diagrama de fase que muestra las condiciones para las transiciones de fase entre la fase sólida y la fase líquida (línea de color verde en el diagrama anterior).
- Curva de sublimación - La línea límite en un diagrama de fase que muestra las condiciones para las transiciones de fase entre la fase continua y la fase gaseosa (línea de color rojo en el diagrama de fase superior).
Aquí, la fusión es la fusión o la congelación que implica la transición de fase entre la fase gaseosa y la fase líquida. La vaporización es la conversión de un líquido en fase de vapor (fase gaseosa), mientras que la condensación es la conversión de un vapor en líquido. La sublimación es la conversión de un sólido en fase gaseosa directamente, sin pasar por una fase líquida.
Tipos de diagrama de fase
Hay pocos tipos de diagramas de fase.
Diagramas de fase unary
Estas son la forma más simple de diagramas de fase. Estos diagramas muestran las tres fases de una sustancia separada de los límites de equilibrio (como en la Figura 1).
Diagramas de fase binarias
Un diagrama de fase binaria muestra el equilibrio entre dos sustancias que existen en el mismo sistema. En la mayoría de los casos, la presión sigue siendo la misma, y las variables son la temperatura y las composiciones de las sustancias. Aquí, las dos sustancias pueden ser metales, un metal y un compuesto o dos compuestos.
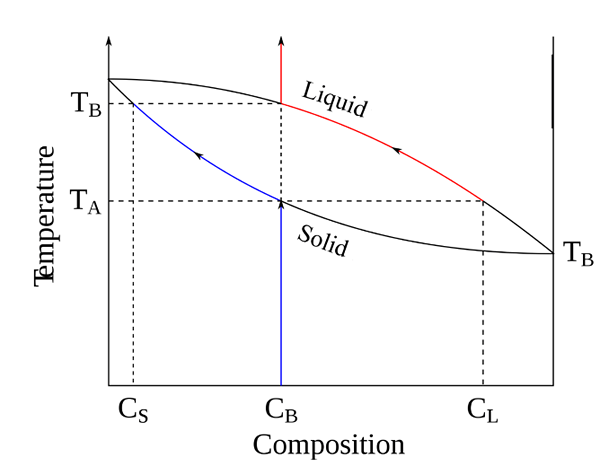
Figura 2: un diagrama de fase binaria
¿Qué es un diagrama de equilibrio??
Un diagrama de equilibrio es un gráfico que muestra el equilibrio entre las fases de una sustancia que coexisten en un sistema cerrado. También se conoce como diagrama de fase.
¿Cuál es la diferencia entre el diagrama de fase y el diagrama de equilibrio??
- No hay diferencia entre el diagrama de fase y el diagrama de equilibrio porque son sinónimos. Ambos términos se refieren al cuadro que resume los detalles sobre las condiciones de los sistemas termodinámicamente distintos que coexisten en equilibrio entre sí.
Resumen -Diagrama de fase vs diagrama de equilibrio
Una fase es una porción homogénea de un sistema que tiene propiedades químicas y físicas uniformes. Hay tres fases principales que cualquier sustancia puede existir: fase sólida, fase líquida y fase gaseosa. Un diagrama de fase es un gráfico que representa el equilibrio existe entre diferentes fases que coexisten en el mismo sistema cerrado. Este diagrama también se llama diagrama de equilibrio porque muestra equilibrio.
Referencia:
1. "Diagrama de equilibrio."El diccionario gratuito, Farlex, disponible aquí.
2. Bibliotecas. "Diagramas de fase."Bibliotecas de química, Librettexts, 6 de febrero. 2018, disponible aquí.
3. "Líquidos."Diagramas de fase, químicos.química. Disponible aquí.
Imagen de cortesía:
1. "Phase-DiaG2" de Matthieumarechal (CC BY-SA 3.0) a través de Commons Wikimedia [modificado]
2. "Diagrama de fase de fusión parcial" por solidificación_1er_cristal.SVG: Cdangderivative Work: Fitzgabbro (charla) - solidificación_1er_cristal.SVG (CC BY-SA 3.0) a través de Commons Wikimedia [modificado]


