Diferencia entre PKA y PKB
Diferencia clave: PKA vs PKB
PKA y PKB son términos comunes en química que se conocen como constantes de disociación. Pka es Constante de disociación ácida, Y PKB es Constante de disociación base. Estos términos se utilizan para facilitar el trabajo con valores muy grandes o muy pequeños. La "P" en estos términos significa "logaritmo negativo". El diferencia clave Entre PKA y PKB es que PKA es el logaritmo negativo de KA, mientras que PKB es el logaritmo negativo de KB.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es pka
3. Que es PKB
4. Relación entre PKA y PKB
5. Comparación de lado a lado - PKA vs PKB en forma tabular
6. Resumen
Que es pka?
PKA es el logaritmo negativo de KA. KA es la constante de disociación ácida de una solución. Es una medición cuantitativa de la resistencia de un ácido en una solución. Los ácidos son compuestos químicos que pueden liberar uno o más iones de hidrógeno (protones) a una solución. Si la disociación ácida constante; KA es más alto, significa que el ácido está completamente (o casi completamente) disociado en iones que forman iones de hidrógeno. Entonces, indica que el ácido es un ácido fuerte. Dado que el PKA es el valor logarítmico negativo de KA, PKA es un valor menor para ácido fuerte.
pka = -log10Ka
Bajo el pka vlaue, más fuerte es el ácido. Del mismo modo, mayor es el valor de PKA, más débil es el ácido. Al observar los valores de PKA de diferentes ácidos, se puede comparar las fortalezas de ácido relativo. En lugar de usar los valores de KA, los valores de PKA se usan en común porque hace más fácil trabajar con números muy grandes o muy pequeños con pequeños decimales.

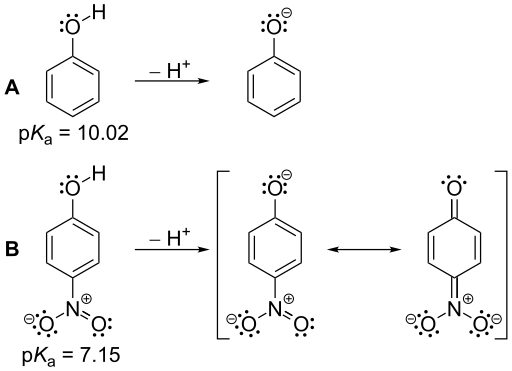
Figura 01: Los valores de PKA de fenol y nitrofenol: el nitrofenol es un ácido más fuerte que el fenol debido a su valor PKA más pequeño en comparación con el nitrofenol.
Además de comparar la resistencia al ácido, los valores de PKA también se usan para seleccionar tampones adecuados. Según la ecuación de Henderson-Hasselbalch, existe una relación entre PH y PKA de un sistema.
ph = PKa + registro10([A-]/[Ah])
Para la disociación del ácido de HA. Esta ecuación se puede reescribir como se muestra a continuación.
Ka/[H+] = [A-]/[Ah]
Según esta ecuación, los valores de PKA y PH del mismo sistema son iguales cuando la mitad del ácido se ha disociado. Dado que la capacidad de amortiguación de un sistema es su capacidad para mantener el pH de una solución, se debe seleccionar el búfer en el que el PKA y el pH están muy cerca el uno del otro.
Que es PKB?
PKB es el logaritmo negativo de KB. KB es la constante de disociación base. Se usa para determinar la resistencia de una base cuantitativamente. Cuando una base se disuelve en agua, se disocia en iones que forman una solución básica. Las bases fuertes se disocian por completo. Las bases débiles se disocian parcialmente.
pkb = -log10Kb
La "P" en PKB significa "logaritmo negativo". Dado que la mayoría de los valores de KB son muy grandes o muy pequeños, los logaritmos negativos de estos valores se utilizan para facilitar. Por lo tanto, un gran valor de KB puede caracterizarse por un pequeño valor de PKB con pequeños decimales.
¿Cuál es la relación entre PKA y PKB??
La relación entre KA y KB se da a continuación.
KW = KA.KB
Entonces la relación entre PKA y PKB se da como (a los 25OC)
PKA + PKB = 14
¿Cuál es la diferencia entre PKA y PKB??
PKA vs PKB | |
| PKA es el logaritmo negativo de KA. | PKB es el logaritmo negativo de KB. |
| Naturaleza | |
| PKA se da por ácidos. | PKB se da para bases. |
| Relación con constante de disociación | |
| PKA está relacionado con la constante de disociación ácida. | PKB está relacionado con la constante de disociación base. |
| Indicación | |
| Más pequeño el valor de pka, más fuerte el ácido. | Más pequeño el valor de PKB, más débil la base. |
Resumen - PKA vs PKB
PKA y PKB se utilizan para comparar la resistencia de los ácidos y las bases respectivamente. PKA se da para disociaciones ácidas. PKB se da para la disociación de bases. La diferencia entre PKA y PKB es que PKA es el logaritmo negativo de KA, mientras que PKB es el logaritmo negativo de KB.
Descargue el PDF de PKA vs PKB
Puede descargar la versión PDF de este artículo y usarla para fines fuera de línea según la nota de cita. Descargue la versión PDF aquí: Diferencia entre PKA y PKB
Referencia:
1.Helmenstine, Anne Marie, D. "Definición de PKA en química."Thinkco, sep. 15, 2017. Disponible aquí
2.Helmenstine, Anne Marie, D. "Relación PH y PKA: la ecuación de Henderson-Hasselbalch."Thinkco, dec. 1, 2017. Disponible aquí
3."Relación entre KA y KB." Academia Khan. Disponible aquí
Imagen de cortesía:
1.'PKA Phenol vs Nitrofenol'by HBF878 - Trabajo propio, (dominio público) a través de Commons Wikimedia


