Diferencia entre las moléculas polares y dipolares
El diferencia clave entre las moléculas polares y dipolares es que Las moléculas polares tienen dos extremos opuestos con cargas eléctricas opuestas, mientras que las moléculas dipolares tienen dos polos.
En general, podemos usar los términos polar y dipolar indistintamente porque ambos términos describen una sola molécula que tiene dos extremos opuestos. Estos diferentes fines surgen debido a la diferencia en la distribución de electrones en toda la molécula.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son las moléculas polares?
3. ¿Qué son las moléculas dipolares?
4. Comparación lado a lado: moléculas dipolares versus polares en forma tabular
5. Resumen
¿Qué son las moléculas polares??
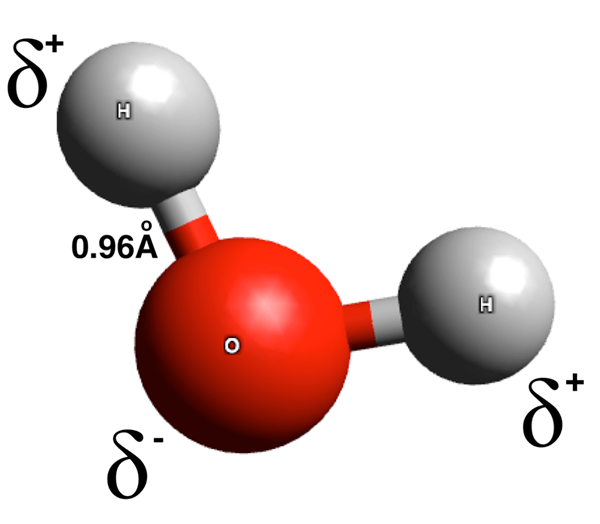
Las moléculas polares son especies químicas que tienen enlaces polares. La suma de los momentos dipolo de estos enlaces polares no es igual a cero. Un enlace polar tiene un final cargado parcialmente positivo y un final cargado parcialmente negativo. Estas cargas eléctricas surgen debido a las diferencias en la distribución de electrones a lo largo del enlace químico. La diferencia en la distribución de electrones es el resultado de la diferencia en el valor de electronegatividad de los átomos en el enlace químico. Aquí, el átomo más electronegativo atrae los electrones del par de electrones de unión hacia sí mismo, lo que le da a este átomo una carga negativa parcial. En consecuencia, el otro átomo en este enlace obtiene una carga positiva parcial debido a la falta de densidad de electrones a su alrededor, lo que revela la carga positiva de los protones en los núcleos atómicos.

Figura 01: Separación de carga en una molécula de agua
Además, una molécula polar puede formarse cuando la disposición espacial de la molécula (geometría) hace que las cargas positivas se reúnan en un lado de la molécula y cargas negativas en el lado opuesto. Algunos ejemplos comunes de moléculas de álamos incluyen agua, amoníaco, etanol, dióxido de azufre y sulfuro de hidrógeno.
¿Qué son las moléculas dipolares??
Las moléculas dipolares son especies químicas que tienen dos polos en la misma molécula. Se produce un momento dipolar cuando hay una separación en las cargas eléctricas debido a la distribución desigual de electrones en toda la molécula. Los momentos dipolo ocurren debido a las diferencias en los valores de electronegatividad de los átomos en la molécula. A diferencia de los compuestos polares, las moléculas dipolares son eléctricamente neutrales (la carga eléctrica general de la molécula es cero). Esto se debe a que la separación de carga de la molécula muestra exactamente el mismo valor de carga eléctrica con exactamente la orientación opuesta, que se cancela entre sí; Por lo tanto, no hay carga neta.
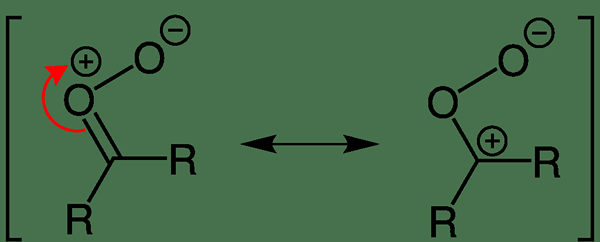
Figura 02: Deslocalización de la carga eléctrica en óxido de carbonilo
En la mayoría de las moléculas dipolares, las cargas se delocalizan en toda la molécula. Algunos ejemplos incluyen óxido de carbonilo, diazometano, fosfonio ylide, etc.
¿Cuál es la diferencia entre las moléculas polares y dipolares??
La diferencia clave entre las moléculas polares y dipolares es que las moléculas polares tienen dos extremos opuestos con cargas eléctricas opuestas, mientras que las moléculas dipolares tienen dos polos. Sin embargo, en términos generales, podemos usar los términos polar y dipolar indistintamente porque ambos términos describen una sola molécula que tiene dos extremos opuestos.
Además, otra diferencia significativa entre las moléculas polares y dipolares es que las moléculas polares se forman cuando hay una separación de carga, mientras que las moléculas dipolares se forman debido a la diferencia en los valores de electronegatividad de los átomos.
A continuación se muestra una tabulación resumida de la diferencia entre las moléculas polares y dipolares.

Resumen - Moléculas dipolares polares vs
En resumen, podemos usar los términos polares y polares indistintamente porque ambos términos describen una sola molécula que tiene dos extremos opuestos. La diferencia clave entre las moléculas polares y dipolares es que las moléculas polares tienen dos extremos opuestos con cargas eléctricas opuestas, mientras que las moléculas dipolares tienen dos polos.
Referencia:
1. "13.3: Polaridad de enlace y momentos dipolo."Bibliotecas de química, Librettexts, 3 de junio de 2019, disponible aquí.
2. "Compuesto dipolar."Wikipedia, Fundación Wikimedia, 13 de julio de 2018, disponible aquí.
Imagen de cortesía:
1. "Modelo de bola y palo de una molécula de agua" de SoonLorpai - Trabajo propio (CC BY -SA 4.0) a través de Commons Wikimedia
2. "Óxido de carbonilo (Criegee Zwitterion)" de Wickey -NL - Trabajo propio (CC0) a través de Commons Wikimedia


