Diferencia entre iones poliatómicos y compuestos
El diferencia clave entre iones poliatómicos y compuestos es que el Los iones poliatómicos tienen una carga eléctrica positiva o negativa, mientras que los compuestos no tienen carga eléctrica neta.
Un ion poliatómico es un término que usamos para nombrar especies químicas que contienen dos o más átomos que tienen una carga eléctrica negativa o positiva neta. La carga eléctrica de este ion es el resultado del número de electrones presentes en cada átomo; Si hay más electrones que el número total de protones en los átomos, obtiene una carga negativa neta y viceversa. Los compuestos, por otro lado, son especies químicas sin carga eléctrica. Tienen un número igual de electrones y protones.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los iones poliatómicos?
3. ¿Qué son los compuestos?
4. Comparación de lado a lado: iones poliatómicos vs compuestos en forma tabular
5. Resumen
¿Qué son los iones poliatómicos??
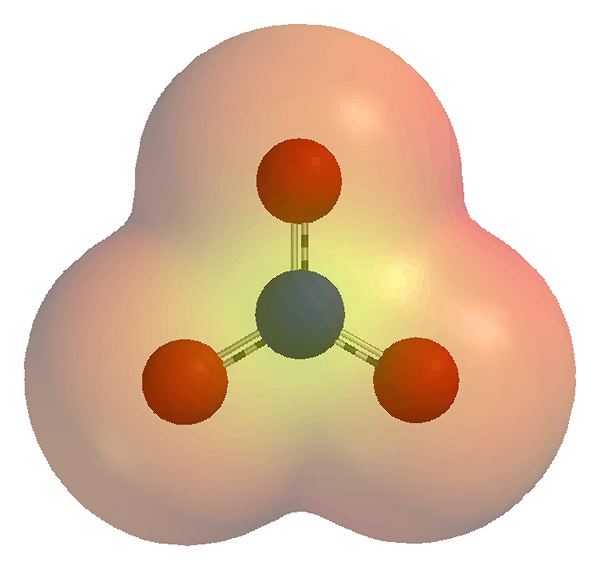
Los iones poliatómicos son especies químicas que tienen dos o más átomos y una carga eléctrica neta. Esta carga eléctrica puede ser una carga positiva o una carga negativa dependiendo del número de electrones y protones presentes en las especies químicas. Un sinónimo de esta especie es "ion molecular". Los átomos se unen entre sí covalentemente. Podemos considerar algunos complejos metálicos como iones poliatómicos si actúan como una sola unidad. En contraste, los iones monoatómicos son átomos individuales, que llevan una carga eléctrica. Podemos encontrar estos iones en compuestos de sal, compuestos de coordinación y muchos otros compuestos iónicos; Como parte del complejo.

Figura 01: un ion nitrato
Algunos ejemplos de iones poliatómicos:
- Ion acetato (CH3ARRULLO-)
- Ion benzoato (C6H5ARRULLO-)
- Ion de carbonato (CO32-)
- Ion cianuro (CN-)
- Ion hidróxido (oh-)
- Ion nitrito (no2-)
- Ion amonio (NH4+)
¿Qué son los compuestos??
Los compuestos son especies químicas que contienen moléculas idénticas consisten en átomos de dos o más elementos químicos. Por lo tanto, estas especies químicas no llevan una carga eléctrica neta. Por lo tanto, son especies neutrales. Los átomos se unen entre sí a través de enlaces covalentes, enlaces de coordinación o enlaces iónicos. Además, si hay una molécula que contiene dos o más átomos del mismo elemento unidos entre sí, no es un compuesto ya que no hay elementos diferentes.
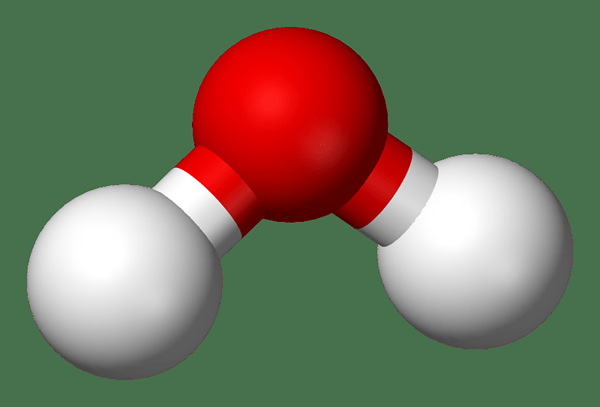
Figura 02: una molécula de agua
Además, según la definición, hay 4 tipos de compuestos de la siguiente manera:
- Moléculas que tienen combinaciones de diferentes elementos químicos
- Los compuestos iónicos consisten en enlaces iónicos
- Compuestos intermetálicos que tienen enlaces metálicos
- Los complejos de coordinación consisten en enlaces coordinados
Podemos usar una fórmula química para expresar los elementos químicos y la relación entre ellos presentes en un complejo. Por ejemplo, la fórmula química de la molécula de agua es H2O. Tiene dos átomos de hidrógeno y un átomo de oxígeno, pero la molécula no tiene carga eléctrica neta; Por lo tanto, es un compuesto químico.
¿Cuál es la diferencia entre iones poliatómicos y compuestos??
Los iones poliatómicos son especies químicas que tienen dos o más átomos y una carga eléctrica neta. Tienen una carga eléctrica positiva o negativa. Los compuestos son especies químicas que contienen moléculas idénticas consisten en átomos de dos o más elementos químicos. No tienen carga eléctrica neta. Esta es la diferencia clave entre los iones poliatómicos y los compuestos. Además, los iones poliatómicos tienen enlaces covalentes o enlaces de coordinación entre los átomos. Mientras que los compuestos pueden tener enlaces covalentes, enlaces iónicos, enlaces metálicos o enlaces de coordinación entre átomos.
La siguiente infografía presenta la diferencia entre iones poliatómicos y compuestos en forma tabular.

Resumen -iones poliatómicos vs compuestos
La diferencia clave entre los iones poliatómicos y los compuestos es que los iones poliatómicos tienen una carga eléctrica positiva o negativa, mientras que los compuestos no tienen carga eléctrica neta. Esto se debe principalmente a que los iones poliatómicos tienen un número desequilibrado de electrones y protones, mientras que los compuestos tienen un número igual de electrones y protones.
Referencia:
1. Helmenstine, Anne Marie, PH.D. “Definición y ejemplos de iones poliatómicos."Thinkco, junio. 22, 2018. Disponible aquí
2. Noller, Carl R., et al. "Compuesto químico."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 6 de diciembre. 2016. Disponible aquí
Imagen de cortesía:
1."Nitrato-ion-elpot" de Benjah-BMM27-Trabajo propio, (dominio público) a través de Commons Wikimedia
2."Water-3D-Balls" de Benjah-BMM27-Trabajo propio, (dominio público) a través de Commons Wikimedia


