Diferencia entre las células primarias y secundarias
Diferencia clave: células primarias y secundarias
Se usan baterías cuando se necesita almacenamiento de energía eléctrica. Acumulan y regalan cargas eléctricas como corriente eléctrica cuando se requiere. Las baterías consisten en celdas primarias o secundarias. El diferencia clave entre las células primarias y secundarias es la reutilización. Las células secundarias se pueden reutilizar una y otra vez, mientras que las células primarias solo se pueden usar una vez. El propósito y la carga conectada a la batería dependen de qué tipo de celdas dentro. Puede haber una o más celdas de un solo tipo en una batería; Entonces eso decide el voltaje, o en otras palabras, la fuerza electromotriz (EMF) de esa batería. Cualquier celda consta de 3 partes principales; a saber, ánodo, cátodo y electrolito.
¿Qué son las células primarias??
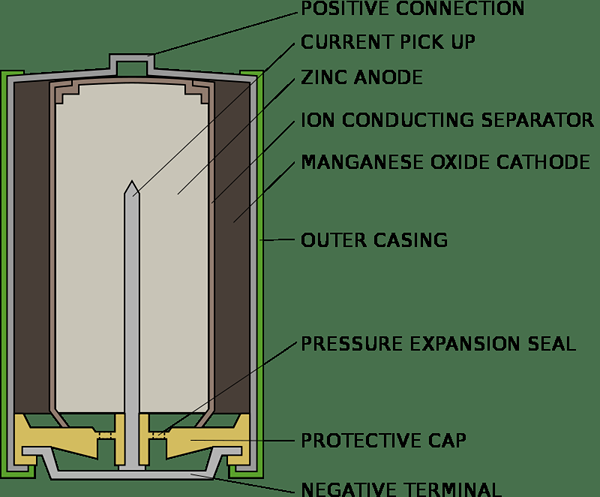
Las células primarias se pueden usar una vez y descartarse. No pueden ser recargados y reutilizados. La etiqueta de una célula primaria siempre establece que no debe recargarse porque es perjudicial intentar recargarse y puede explotarse, si lo hace. Las células secas y las células de mercurio son ejemplos de células primarias. La célula primaria es esencialmente una célula química y produce corriente eléctrica mediante una reacción química irreversible. Una vez que se realiza la reacción, no se puede restablecer. Para un instante, una célula seca consiste en un cátodo de carbono rodeado por NH4CL en un contenedor Zink. Una pasta de NH4Cl y Zncl2 sirve como electrolito, mientras que el contenedor de zinc actúa como el ánodo. Una pequeña cantidad de mno2 también se mezcla con el electrolito. El proceso químico de una célula seca se puede resumir de la siguiente manera;
Zn-> zn2++2 Electron (reacción del ánodo)
NUEVA HAMPSHIRE4+ + Mno2 + Electron -> Mno (OH) + NH3 (Reacción del cátodo)
Las células primarias se encuentran comúnmente y se usan en la mayoría de los juguetes eléctricos, relojes, relojes y controladores remotos nacionales.

¿Qué son las células secundarias??
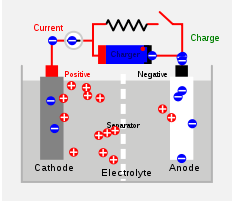
La célula secundaria también es una célula química, pero se puede recargar para usar nuevamente. La reacción química que produce electricidad es reversible, y la célula puede usarse como nueva después del proceso de recarga. La célula se puede reutilizar pero la vida se acorta. Lead-ácid y Life Cell son algunos ejemplos de células secundarias. en un Célula de plomo-ácido, El plomo actúa como el ánodo y una cuadrícula de plomo llena de dióxido de plomo actúa como el cátodo. El ácido sulfúrico se llena para servir como electrolito. Las reacciones químicas dentro de una célula de plomo-ácido se dan a continuación. Son procesos reversibles.
PB+42- --> PBSO4 + 2 Electron (reacción del ánodo)
PBO2 + 4h+ + ENTONCES42- + 2 Electrones -> PBSO4 + 2h2O (reacción del cátodo)
Los vehículos híbridos modernos funcionan con energía de petróleo y electricidad. La batería se carga cuando el automóvil se mueve, y luego la energía eléctrica almacenada se puede usar para funcionar. Todos los paquetes de baterías dentro de esos automóviles están hechos de celdas secundarias. Otro uso común para las baterías secundarias es para comenzar, iluminar y encender en vehículos. Además, se utilizan en fuentes de alimentación ininterrumpidos (UPSS), telecomunicaciones y herramientas portátiles.
¿Cuál es la diferencia entre las células primarias y secundarias??
Rentabilidad:
Usando células primarias es rentable en comparación con las células secundarias, inicialmente.
Pero usando células secundarias sería una inversión a largo plazo ya que las células primarias deben ser reemplazadas por otro conjunto después de un tiempo.
Tasa de autodescargo:
Células primarias tienen una tasa de autodescarga más baja, por lo tanto, son adecuados para dispositivos de funcionamiento en espera que necesitan pequeñas corrientes continuamente durante mucho tiempo. Es un hecho importante en nombre de equipos de seguridad, como detectores de humo/ incendios, alarmas antirrobo y relojes.
Células secundarias tener una mayor descarga.
Costo y uso:
Células primarias son baratos y fáciles de usar.
Células secundarias son caros y más complejos en el uso.
Imagen de cortesía:
1. "Alkaline-Battery-Inglish" por Timpanus [dominio público] a través de Commons
2. Diagrama de células secundarias del autor original: Barrie Lawson. [CC BY-SA 3.0], a través de Wikimedia Commons


