Diferencia entre la valencia primaria y secundaria
El diferencia clave Entre la valencia primaria y secundaria es que La valencia primaria es el estado de oxidación del átomo de metal central de un complejo de coordinación, mientras que la valencia secundaria es el número de coordinación del átomo de metal central de un complejo de coordinación.
Los términos valencia primaria y secundaria se dividen en química de coordinación. La valencia es la potencia de combinación de un elemento, especialmente según lo medido por el número de átomos de hidrógeno que puede desplazar o combinar con.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la valencia principal?
3. ¿Qué es la valencia secundaria?
4. Comparación de lado a lado - Valencia primaria vs secundaria en forma tabular
5. Resumen
¿Qué es la valencia principal??
La valencia primaria es el estado de oxidación del átomo de metal central de un complejo de coordinación. Un complejo de coordinación es un compuesto complicado que tiene un ion metálico en el centro, que está rodeado por varios átomos o grupos de átomos. Estas especies químicas circundantes se llaman ligandos. El átomo de metal central se une con un cierto número de ligandos dependiendo de la configuración de electrones de ese átomo. El número de ligandos que se une al átomo de metal central se llama número de coordinación.
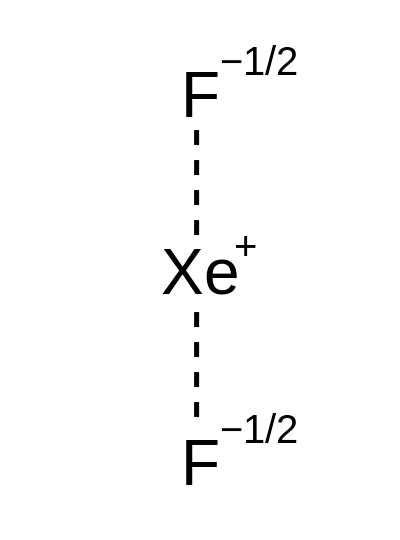
Además, el átomo de metal central tiene su propio estado de oxidación. Podemos calcular el estado de oxidación utilizando la fórmula química del complejo. Aquí, si conocemos la carga eléctrica neta del complejo, las cargas y el número de ligandos unidos al átomo de metal, podemos calcular fácilmente el estado de oxidación. En otras palabras, la valencia primaria es el número de ligandos que necesitamos para satisfacer la carga del ion metal.
¿Qué es la valencia secundaria?
La valencia secundaria es el número de coordinación del átomo de metal central de un complejo de coordinación. El número de coordinación es el número de ligandos unidos al átomo de metal central. Consideremos un ejemplo para comprender las valencias primarias y secundarias. En el complejo de coordinación k4[Fe (CN)6] El átomo de metal central es hierro (Fe).

Figura 02: El número de coordinación de azufre en este compuesto de coordinación es cuatro
Podemos calcular la valencia primaria como a continuación:
- La carga del ligando de potasio es siempre +1.
- La carga del ligando cianuro (CN) siempre es -1.
- Hay cuatro ligandos de potasio que equivalen a +4 carga.
- Hay seis ligandos de cianuro (CN) que equivalen a -6 carga.
- Entonces podemos calcular el estado de oxidación de Fe de la siguiente manera:
La carga total del complejo = 0
0 = [(CARGA DEL LIGANDO DE POTASIO) X 4] + [CARGA DEL ION FE] + [(CARGA DEL LIGANDO CYANIDE) X 6]
0 = [(+1) x 4] + [Charge of the Fe ion] + [(-1) x 6]
0 = 4 + [Cargo del ion Fe] - 6
Cargo del ion Fe = +2
Estado de oxidación de Fe = +2
¿Cuál es la diferencia entre la valencia primaria y secundaria??
Los términos valencia primaria y secundaria están en el campo de la química de coordinación. Aquí, la diferencia clave entre la valencia primaria y secundaria es que la valencia primaria es el estado de oxidación del átomo de metal central de un complejo de coordinación. Pero, la valencia secundaria es el número de coordinación del átomo de metal central de un complejo de coordinación. Además, la valencia primaria es el número de ligandos que necesitamos para satisfacer la carga del ion metálico, mientras que la valencia secundaria es el número de ligandos unidos al átomo de metal central.
Debajo de la infografía resume la diferencia entre la valencia primaria y secundaria.
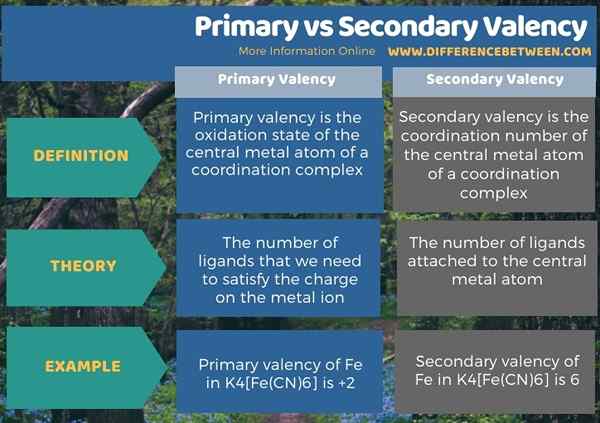
Resumen -Valencia primaria vs secundaria
Los términos valencia primaria y secundaria están bajo la química de coordinación. La diferencia clave entre la valencia primaria y secundaria es que la valencia primaria es el estado de oxidación del átomo de metal central de un complejo de coordinación. Pero, mientras que la valencia secundaria es el número de coordinación del átomo de metal central de un complejo de coordinación.
Referencia:
1. "Metales de transición."Complejos de coordinación y ligandos, disponibles aquí.
2. "Hibridización orbital."Wikipedia, Fundación Wikimedia, 14 de noviembre. 2019, disponible aquí.
3. "Química ilimitada.Lumen, disponible aquí.
Imagen de cortesía:
1. "Di Xeno" por Oficial781 - Trabajo propio (dominio público) a través de Commons Wikimedia
2. "Tetra Sulf" por Oficial781 - Trabajo propio (dominio público) a través de Commons Wikimedia


