Diferencia entre el grupo protésico y la coenzima
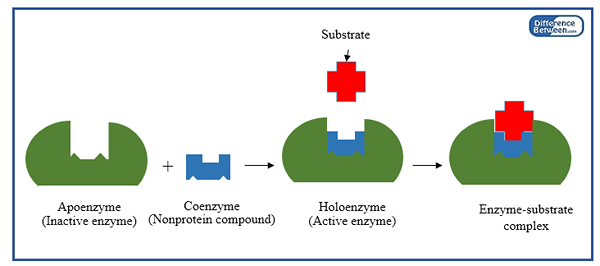
Diferencia clave: grupo protésico vs coenzima
Las enzimas son los catalizadores biológicos de las reacciones químicas que ocurren en las células vivas. Algunas enzimas requieren moléculas de ayuda o moléculas de pareja para catalizar reacciones bioquímicas. Estas moléculas se conocen como cofactores. Los cofactores son moléculas no proteicas que ayudan a las reacciones químicas a proceder. Ayudan a aumentar la velocidad de la reacción. Los cofactores pueden ser inorgánicos u orgánicos. Están compuestos por varios tipos de moléculas como vitaminas, iones metálicos, moléculas no vitaminas, etc. El grupo protésico y la coenzima son dos tipos de moléculas auxiliar de enzimas. La diferencia clave entre el grupo protésico y la coenzima es que El grupo protésico se une firmemente con la enzima para ayudar a la enzima mientras La coenzima se une libremente con una enzima para soportar su función catalítica. Los grupos protésicos pueden ser moléculas orgánicas o iones metálicos, mientras que las coenzimas son moléculas totalmente orgánicas.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es un grupo protésico?
3. ¿Qué es una coenzima?
4. Comparación de lado a lado - Grupo protésico vs coenzima
5. Resumen
¿Qué es un grupo protésico??
Un grupo protésico es un cofactor que se une fuertemente a la enzima y ayuda a catalizar la reacción química. Son moléculas no proteicas. Pueden ser pequeñas moléculas orgánicas o iones metálicos. Debido a la unión estrecha a la enzima, los grupos protésicos son difíciles de eliminar de las enzimas. Por lo tanto, se considera que el enlace entre el grupo protésico y la enzima es permanente a diferencia de las coenzimas. Tras la unión, pueden actuar como elementos estructurales o como portadores de carga. Por ejemplo, el grupo protésico hemo en hemoglobina y mioglobina permite la unión y liberación de oxígeno según el requisito de los tejidos. Hay algunas vitaminas que actúan como grupos protésicos para las enzimas.
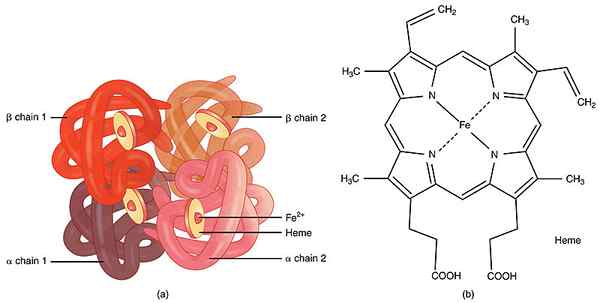
Figura 01: Grupo protésico hemo en la molécula de hemoglobina
¿Qué es una coenzima??
La coenzima es un tipo específico de cofactor que ayuda a las enzimas a realizar su función. Están involucrados en aumentar la velocidad de la reacción. Las coenzimas son compuestos no proteicos que funcionan con enzimas. Son moléculas orgánicas pequeñas (moléculas que contienen carbono) derivadas principalmente de vitaminas. Se unen libremente con el sitio activo de la enzima y los ayudan a reconocer, atraer y rechazar sustratos. La presencia de una coenzima es esencial para que algunas enzimas inicien y realicen la función catalítica. Actúan como portadores intermedios y cosubstratos también.
Las coenzimas no son específicas para las enzimas. Pueden unirse con muchos tipos diferentes de enzimas y ayudarlos a realizar reacciones químicas. Por lo tanto, son reutilizables. Estas coenzimas pueden cambiar sus estructuras a formas alternativas cuando es esencial. Las coenzimas no pueden trabajar solas. Deben unirse con la enzima. Cuando una coenzima se une con la apoenzima, se convierte en una holoenzima que es la forma activa de la enzima que cataliza las reacciones químicas.
Los ejemplos de coenzimas incluyen vitamina C, vitamina B, S-adenosil metionina, ATP, coenzima A, etc.

Figura 02: Coenzima
¿Cuál es la diferencia entre el grupo protésico y la coenzima??
Grupo protésico vs coenzima | |
| El grupo protésico es un tipo de molécula auxiliar que es un compuesto no proteináceo que ayuda a las enzimas a realizar sus funciones. | La coenzima es un tipo específico de molécula de cofactor que es una molécula orgánica que ayuda a las enzimas a catalizar las reacciones químicas. |
| Enlace con enzimas | |
| Se unen bien o covalentemente con enzimas para ayudar a las enzimas. | Se unen libremente con el sitio activo de la enzima para ayudar a la función catalítica. |
| Composición | |
| Los grupos protésicos son iones metálicos, vitaminas, lípidos o azúcares. | Las coenzimas son vitaminas, derivados de vitaminas o nucleótidos. |
| Función principal | |
| El grupo protésico proporciona principalmente una propiedad estructural a la enzima. | La coenzima proporciona principalmente una propiedad funcional a la enzima. |
| Eliminación de la enzima | |
| Los grupos protésicos no se pueden eliminar fácilmente de las enzimas. | Las coenzimas se pueden eliminar fácilmente de las enzimas. |
| Ejemplos | |
| Los ejemplos incluyen nucleótidos de flavina y hemo. | Los ejemplos incluyen AMP, ATP, Coenzyme A, FAD y NAD+, S-adenosil metionina |
Resumen - Grupo protésico vs coenzima
Los cofactores son las moléculas auxiliares de las enzimas. No son proteínas y son moléculas inorgánicas o orgánicas. Las coenzimas y los grupos protésicos son dos tipos de moléculas auxiliares. Una coenzima es una molécula orgánica que se une libremente con las enzimas para ayudar a las reacciones. Un grupo protésico es una molécula orgánica o un hierro de metal que se une de manera estrecha o covalente con la enzima para ayudar a las reacciones químicas. Esta es la diferencia entre el grupo protésico y la coenzima. Ambos grupos son reutilizables e inespecíficos para las enzimas.
Referencia:
1. "Cofactor (bioquímica)."Wikipedia. Fundación Wikimedia, 14 de mayo de 2017. Web. 17 de mayo de 2017. .
2. Klucevsek, Kristin. “Coenzimas, cofactores y grupos protésicos: función e interacciones." Estudiar.comunicarse. Estudiar.com, n.d. Web. 17 de mayo de 2017. http: // estudio.com/academia/lección/coenzimas cofactores-grupos-grupos-funciones-funciones e interacciones.html
3. Helmenstine, ph.D. Ana María. "¿Qué es una coenzima?? Definición y ejemplos."THEWLECO. norte.pag., norte.d. Web. 17 de mayo de 2017. .
4. Hashim, Onn H., y ni azila adnan. “Grupo de coenzima, cofactor y protésico - jerga bioquímica ambigua."Educación bioquímica. Headington Hill Hall, 30 de junio de 2010. Web. 17 de mayo de 2017
Imagen de cortesía:
1. "1904 Hemoglobin" de OpenStax College - Anatomía y fisiología, Sitio web de Connexions. 19 de junio de 2013. (CC por 3.0) a través de Commons Wikimedia


