Diferencia entre solventes de protección y aprótica

Diferencia clave - Proópico VS Aprótico Solventes
El diferencia clave entre los solventes de protección y aprótica es que Los disolventes protícicos tienen átomos de hidrógeno disociables, mientras que los solventes apróticos no tienen un átomo de hidrógeno disociable.
Un disolvente es un compuesto líquido que puede disolver otras sustancias. Existen diferentes formas de solventes que se pueden clasificar básicamente en dos grupos como solventes polares y no polares. Los solventes polares se pueden dividir en dos grupos como solventes de protección y aprótica. Los solventes de protección pueden formar enlaces de hidrógeno porque tienen enlaces químicos necesarios para el enlace de hidrógeno, i.mi. Bono O-H y Bond N-H. En contraste, los solventes apróticos carecen de los enlaces químicos necesarios para la unión de hidrógeno.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los solventes de protección?
3. ¿Qué son los solventes apróticos?
4. Similitudes entre solventes de protección y aprótica
5. Comparación de lado a lado - Solventes Apróticos Protic vs Apróticos en forma tabular
6. Resumen
¿Qué son los solventes de protección??
Los disolventes protícicos son compuestos líquidos polares que tienen átomos de hidrógeno disociables. Estos solventes tienen muchos enlaces O-H y enlaces N-H. Los átomos de hidrógeno disociables son aquellos que están unidos a átomos de oxígeno y átomos de nitrógeno en estos enlaces O-H y N-H. Por lo tanto, grupos hidroxilo (-OH) y grupos aminos (-nh2) son componentes esenciales en solventes de protección.
Los solventes de protección comparten potencia de disolución de iones con solventes apróticos y son ácidos (porque pueden liberar protones). La constante dieléctrica de estos solventes de protección es muy alta (la constante dieléctrica es una propiedad de los materiales aislantes eléctricos y es una cantidad que mide la capacidad de una sustancia para almacenar energía eléctrica en un campo eléctrico).
Los ejemplos de solventes de protección incluyen agua, alcoholes como metanol y etanol, fluoruro de hidrógeno (HF) y amoníaco (NH3). Estos solventes a menudo se usan para disolver sales. Los solventes de protección polar prefieren sufrir reacciones SN1.
¿Qué son los solventes apróticos??
Los solventes apróticos son compuestos líquidos polares que no tienen átomos de hidrógeno disociables. Estos solventes carecen de cuerpos químicos como enlaces O-H y enlaces N-H. Por lo tanto, los solventes apróticos carecen de grupos hidroxilo (-OH) y grupos de amina (-nh2) y no pueden formar enlaces de hidrógeno.
Los solventes apróticos comparten el poder de disolución de iones con solventes de protección. Estos solventes apróticos carecen de hidrógeno ácido, por lo que no hay una liberación considerable de iones de hidrógeno. Los solventes apróticos polar tienen valores constantes dieléctricos bajos o intermedios. Estos solventes muestran una polaridad moderada.
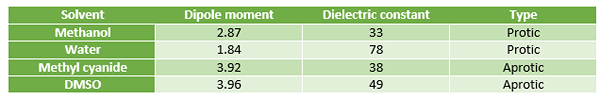
Figura 01: Comparación entre solventes protícicos y apróticos
Los ejemplos de solventes apróticos incluyen diclorometano (DCM), tetrahidrofurano (THF), acetato de etilo y acetona. Se pueden usar solventes apróticos para disolver sales. Estos solventes prefieren sufrir reacciones SN2.
¿Cuáles son las similitudes entre los solventes de protección y aprótica??
- Los solventes de protección y aprótica son solventes polares.
- Los solventes de solventes de protección y aprótica pueden disolver sales.
¿Cuál es la diferencia entre los solventes de protección y aprótica??
Solventes Protic vs Apróticos | |
| Los disolventes protícicos son compuestos líquidos polares que tienen átomos de hidrógeno disociables. | Los solventes apróticos son compuestos líquidos polares que no tienen átomos de hidrógeno disociables. |
| Formación de enlaces de hidrógeno | |
| Los solventes de protección son capaces de formación de enlaces de hidrógeno. | Los solventes apróticos no pueden formar enlaces de hidrógeno. |
| Acidez | |
| Los solventes de protección son ácidos. | Los solventes apróticos no son ácidos. |
| Enlaces químicos presentes | |
| Los solventes de protección son ricos con enlaces O-H y enlaces N-H. | Los solventes apróticos carecen de enlaces O-H y enlaces N-H. |
| Constante dieléctrica | |
| Los solventes de protección tienen una alta constante dieléctrica. | Los solventes apróticos tienen una constante dieléctrica baja. |
| Tipo de reacción preferido | |
| Los solventes de protección prefieren sufrir reacciones SN1. | Los solventes apróticos prefieren sufrir reacciones SN2. |
Resumen -Proópico VS Aprótico Solventes
Los solventes son líquidos que son capaces de disolver sustancias. Los solventes se pueden encontrar en dos formas principales como solventes polares y solventes no polares. Los solventes polares se pueden dividir nuevamente en dos grupos como solventes de protección y solventes apróticos. La diferencia entre los solventes protícicos y apróticos es que los solventes de protección tienen átomos de hidrógeno disociables, mientras que los solventes apróticos no tienen átomo de hidrógeno disociable.
Referencia:
1."Proópico polar? Aprótico polar? No polar? Todo sobre solventes."Master Organic Chemistry RSS. Disponible aquí
2."Solvente protícico."Wikipedia, Fundación Wikimedia, 17 de diciembre. 2017. Disponible aquí
3."Solventes apróticos y de protección."Scribd, Scribd. Disponible aquí


