Diferencia entre protio y deuterio

El diferencia clave Entre Protium y Deuterium es que El protio no tiene neutrones en su núcleo atómico, mientras que Deuterium tiene un neutrón.
Protium y Deuterium son isótopos de hidrógeno. Por lo tanto, difieren entre sí según el número de neutrones presentes en sus núcleos atómicos. El hidrógeno contiene un protón en el núcleo atómico: por lo tanto, el número atómico de hidrógeno es 1. Hay tres isótopos de hidrógeno. Los tres isótopos también contienen un protón. Podemos denotar los tres isótopos como 1H, 2Mano 3H. Los valores en SuperScript son las masas atómicas de estos elementos.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es protio
3. ¿Qué es deuterio?
4. Comparación de lado a lado - Protium vs Deuterium en forma tabular
5. Resumen
Que es protio?
El protio es un isótopo de hidrógeno que contiene un protón y un electrón. No tiene neutrones en el núcleo atómico. Por lo tanto, solo hay un protón en el núcleo. Este isótopo se nombra como tal debido a la presencia de este solo protón. Podemos denotar es como 1H o hidrógeno-1, donde 1 es la masa atómica del protio.

El protio es el isótopo más común y abundante de hidrógeno. La abundancia es de aproximadamente el 99%. Esto se considera un isótopo estable porque el protón en este átomo nunca se ha observado que se descomponga. Sin embargo, según las teorías, sufre descomposición con una vida media muy grande, de modo que no sea observable.
¿Qué es deuterio??
Deuterium es un isótopo de hidrógeno que tiene un protón, un neutrón y un electrón. A diferencia de Protium, este isótopo tiene un protón y un neutrón juntos en el núcleo atómico. Por lo tanto, la masa atómica de este isótopo es 2. Entonces podemos nombrarlo como hidrógeno-2 o 2H. Deuterium también es un isótopo estable de hidrógeno. Sin embargo, no es abundante en comparación con el protio. La abundancia varía entre 0.0026-0.0184%. A diferencia de Tritium, Deuterium no es radiactivo. Tampoco muestra toxicidad.
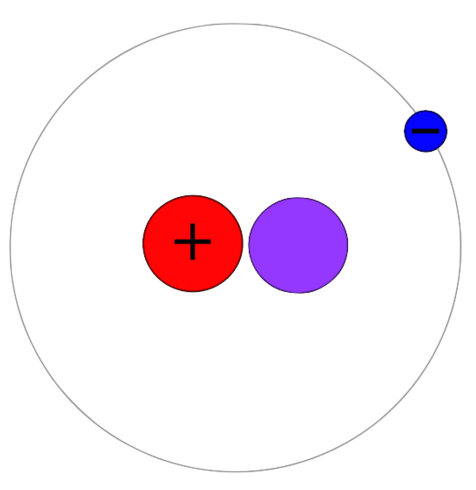
El agua generalmente contiene hidrógeno-1 combinado con átomos de oxígeno. Pero puede haber hidrógeno-2 combinado con oxígeno, que forma agua. Es agua pesada. La fórmula química para agua pesada es D2O donde d es deuterium y o es oxígeno. Además, podemos usar Deuterium y sus compuestos en experimentos químicos. Por ejemplo, son útiles como etiquetas no radioactivas en experimentos como solventes utilizados en la espectroscopía de RMN. Además, podemos usar agua pesada como moderador de neutrones y refrigerante para los reactores nucleares. Deuterium también es un combustible para la fisión nuclear que se lleva a cabo a escala comercial.
¿Cuál es la diferencia entre Protium y Deuterium??
Hay tres isótopos de hidrógeno: protio, deuterio y tritio. La diferencia clave entre el protio y el deuterio es que el protio no tiene neutrones en su núcleo atómico, mientras que Deuterium tiene un neutrón. Por lo tanto, los tres isótopos difieren entre sí según el número de neutrones presentes en sus núcleos atómicos. Además, debido a esta razón, la masa atómica de protio es 1, mientras que la masa atómica de deuterio es 2.
Además, podemos denotar el isótopo de protio como hidrógeno-1 o 1H y el isótopo de deuterio como hidrógeno-2 o 2H. El protio es el isótopo de hidrógeno más abundante, y su abundancia es de aproximadamente el 99%; Deuterium es relativamente menos abundante (alrededor de 0.002%). Sin embargo, también es estable como protio.
Debajo de la infografía resume la diferencia entre protio y deuterio.

Resumen -Protium vs Deuterium
Hay tres isótopos de hidrógeno: protio, deuterio y tritio. Estos tres isótopos difieren entre sí dependiendo de la masa atómica, que es el número de protones y neutrones en el núcleo atómico. La diferencia clave entre el protio y el deuterio es que el protio no tiene neutrones en su núcleo atómico, mientras que Deuterium tiene un neutrón.
Referencia:
1. Helmenstine, Anne Marie. "¿Es Deuterium radiactivo??"Thoughtco, puede. 20, 2019, disponible aquí.
Imagen de cortesía:
1. "Hidrógeno" por MetS501 - Trabajo propio (CC BY -SA 3.0) a través de Commons Wikimedia
2. "Atom H -2" de Zyjacklin - Trabajo propio (CC0) a través de Commons Wikimedia


