Diferencia entre los orbitales PX PY y PZ
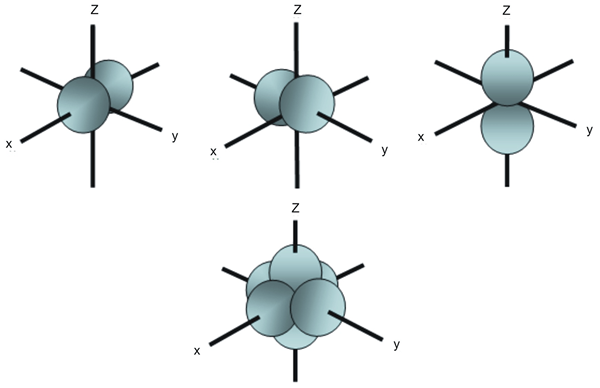
La diferencia clave entre los orbitales PX PY y PZ es que el PX Orbital tiene dos lóbulos orientados a lo largo del eje X y el orbital PY tiene dos lóbulos orientados a lo largo del eje Y, mientras que el orbital PZ tiene dos lóbulos orientados a lo largo del eje Z. Por lo tanto, la diferencia entre los orbitales PX PY y PZ surge de su orientación en el espacio.
Un orbital atómico es una región alrededor de un núcleo atómico, que tiene la mayor probabilidad de encontrar un electrón. Los orbitales de un átomo pueden ser s orbital, orbital p, orbital d o f orbital. Además, hay tres orbitales P; son orbitales PX, PY y PZ.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es un orbital PX?
3. ¿Qué es un orbital py?
4. ¿Qué es un orbital PZ?
5. Similitudes entre los orbitales PX PY y PZ
6. Comparación lado a lado: orbitales PX vs Py vs PZ en forma tabular
7. Resumen
¿Qué es un orbital PX??
PX Orbital es uno de los tres orbitales y orients P a lo largo del eje X. Además, este orbital tiene dos lóbulos y tiene una forma de mancuerna. Los números cuánticos son un conjunto de números que ayudan a nombrar orbitales atómicos. Este sistema le da a un orbital atómico particular un nombre único.

Figura 1: Diferentes orbitales de P y sus orientaciones
Números cuánticos:
- Número cuántico principal (n) describe la carcasa de electrones. Ej: n = 1, 2, 3 ..
- El número cuántico azimutal o el número cuántico de momento angular (L) explica las subshells. Ej: L = 0, 1, 2 ..
- El número cuántico magnético (M) indica el estado cuántico único de un electrón. Ej: M = ... -2, -1, 0, +1, +2 ..
- El número (s) de Spin Quantum describe el giro de un electrón. Ej: S = ±
Al considerar el orbital PX, la notación cuántica es la siguiente.
- Cuando n = 1, no hay orbitales P.
- Cuando n> 2 y l = 1, hay orbitales P. Entonces, Px es M = +1 o M = -1.
- Con el aumento de los valores de N, el tamaño del lóbulo exterior del orbital PX aumenta gradualmente, mientras que el tamaño del lóbulo interno disminuye.
¿Qué es un orbital py??
PY Orbital es uno de los tres orbitales P orientados a lo largo del eje Y. Este orbital tiene dos lóbulos. La notación cuántica del orbital PY es la siguiente.
- Cuando n = 1, no hay orbitales P.
- Cuando n> 2 y l = 1, hay orbitales P. Entonces, Py es M = +1 o M = -1.
- Con el aumento de los valores de N, el tamaño del lóbulo exterior del orbital PY aumenta gradualmente, mientras que el tamaño del lóbulo interno disminuye.
¿Qué es un orbital PZ??
PZ Orbital es uno de los tres orbitales P orientados a lo largo del eje z. Este orbital tiene dos lóbulos y tiene una forma de pesas. La notación cuántica del orbital PY es la siguiente:
- Cuando n = 1, no hay orbitales P.
- Cuando n> 2 y l = 1, hay orbitales P. Entonces, PZ es M = 0.
- Con el aumento de los valores de N, el tamaño del lóbulo externo del orbital PZ aumenta gradualmente, mientras que el tamaño del lóbulo interno disminuye.
¿Cuáles son las similitudes entre los orbitales PX PY y PZ??
- Los orbitales PX PY y PZ tienen una forma similar (forma de mancuerna).
- Los tres orbitales P tienen un tamaño similar.
- Los tamaños de estos orbitales cambian con el aumento del valor de N.
- Los tres orbitales contienen dos lóbulos a lo largo de la misma orientación del eje.
¿Cuál es la diferencia entre los orbitales PX PY y PZ??
PX PY vs PZ Orbitals | ||
| PX Orbital es un orbital P orientado a lo largo del eje X. | PY Orbital es un orbital P orientado a lo largo del eje Y. | PZ Orbital es un orbital P orientado a lo largo del eje z. |
| Orientación | ||
| A lo largo del eje x | A lo largo del eje Y | A lo largo del eje z |
| Valor del número cuántico magnético (M) | ||
| El valor para el número cuántico magnético (M) es +1 o -1. | El valor para el número cuántico magnético (M) es +1 o -1 | El valor para el número cuántico magnético (m) es 0 (cero) |
Resumen -Orbitales PX PY vs PZ
Hay tres orbitales atómicos p en un átomo. Los nombres PX, Py y Pz, indican la orientación del orbital en el espacio. La diferencia clave entre los orbitales PX PY y PZ es que el orbital PX tiene dos lóbulos orientados a lo largo del eje X y el orbital PY tiene dos lóbulos orientados a lo largo del eje Y, mientras que PZ Orbital tiene dos lóbulos orientados a lo largo del eje Z.
Referencia:
1. "Orbital atómico."Wikipedia, Fundación Wikimedia, 24 de abril. 2018, disponible aquí.
2. Bibliotecas. "Orbitales atómicos."Bibliotecas de química, Librettexts, 7 de febrero. 2018, disponible aquí.
3. Agray, Santosh. "Formas de orbitales."Descripción de química, disponible aquí.
Imagen de cortesía:
1."PX PY PZ Orbitals” por la Fundación CK -12 - Archivo: Química de la escuela secundaria.PDF, página 268 (CC BY-SA 3.0) a través de Commons Wikimedia


