Diferencia entre piruvato y ácido piruvico
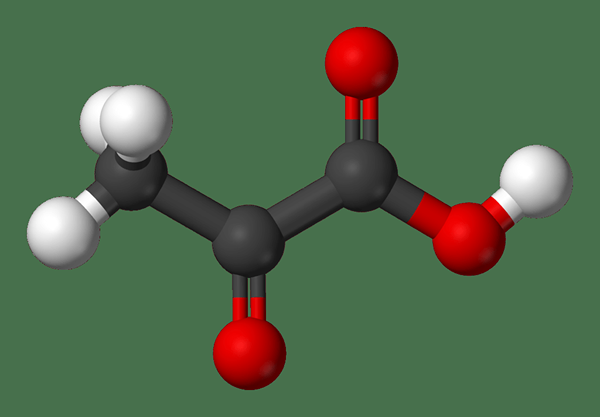
Diferencia clave: ácido piruvato vs pirúbico
Los términos piruvato y ácido pirúvico se usan con frecuencia indistintamente; Sin embargo, hay una clara diferencia entre ellos: El ácido piruvico es un ácido, lo que indica que puede liberar un ion de hidrógeno y unirse con un ion de sodio o potasio cargado positivamente Para formar una sal ácida, también conocida como piruvato. En otras palabras, El piruvato es una sal o un éster de ácido piruvico. Este es el diferencia clave Entre el piruvato y el ácido pirúvico y ambas sustancias se utilizan en las vías biológicas y metabólicas, pero están estrechamente interconectadas.
¿Qué es el ácido piruvico??
El ácido piruvico juega un papel importante en el metabolismo humano. Por ejemplo, la energía se proporciona a las células vivas por respiración aeróbica celular o el ácido piruvico se fermenta para producir ácido láctico a través de la fermentación. El ácido piruvico es una naturaleza líquida, y es incoloro y tiene un olor similar al ácido acético. Es un ácido débil, y se disuelve en agua. La fórmula química del ácido piruvico es (CH3Cocooh), y se considera la forma más simple de los alfa-ceta ácidos con un ácido carboxílico y un grupo funcional de cetona. Además de eso, el ácido piruvico es un ácido carboxílico que no es tan fuerte como los ácidos inorgánicos como el ácido clorhídrico.
Que es piruvato?
El piruvato es la base conjugada del ácido piruvico y su fórmula química es ch3cocoo-. En otras palabras, el piruvato es el anión producido a partir del ácido piruvico. La diferencia clave entre el ácido pirúvico y el piruvato es que el átomo de hidrógeno en el grupo de ácido carboxílico se ha disociado, o se ha eliminado. Esto proporciona un grupo carboxilato cargado negativamente al piruvato. Debido a la débil acidez de la naturaleza del ácido pirúvico, se disocia fácilmente en el agua y formando así piruvato. El piruvato es un compuesto químico importante en el metabolismo humano y la bioquímica. El piruvato está involucrado en el metabolismo de la glucosa y también se conoce como glucólisis. En el proceso de glucólisis, una molécula de glucosa se descompone en dos moléculas de piruvato, que luego se utilizan en reacciones adicionales para producir energía.
¿Cuál es la diferencia entre piruvato y ácido piruvico??
El piruvato y el ácido pirúvico pueden tener efectos químicos sustancialmente diferentes y algunas propiedades funcionales. Estas diferencias se discuten aquí.
Definicion de Piruvato y ácido piruvico
Ácido pirúvico: El ácido piruvico es un color amarillento ácido orgánico.
Piruvato: El piruvato es una sal o un éster de ácido piruvico.
Características de Piruvato y ácido piruvico
Fórmula química y estructura molecular
Ácido pirúvico : CH3Coco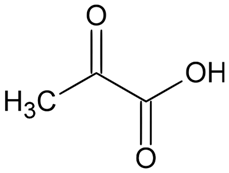
Piruvato: Ch3cocoo-
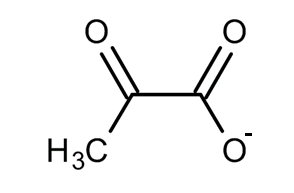
Balance de protones y electrones
Ácido pirúvico: El ácido piruvico tiene el El mismo número de electrones que protones.
Piruvato: Piruvato tiene Más electrones que protones.
Síntesis
Ácido pirúvico: El ácido pirúvico se puede sintetizar a partir de ácido láctico.
Piruvato: El piruvato es el anión sintetizado a partir del ácido piruvico. Cuando el ácido pirúbico se disuelve en agua, tiende a disociar y sintetizar un ion piruvato y un protón.
Acidez
Ácido pirúvico: El ácido piruvico es un ácido orgánico débil.
Piruvato: El piruvato es la base conjugada del ácido piruvico.
Grupo funcional carboxílico
Ácido pirúvico: El ácido piruvico tiene grupo funcional de ácido carboxílico (COOH).
Piruvato: El piruvato se llama anión carboxilato que contiene COO-.
Cargar
Ácido pirúvico: El ácido piruvico tiene un carga neutral.
Piruvato: Pyruvato tiene un carga negativa.
Capacidad para dar un protón
Ácido pirúvico: El ácido piruvico tiene la capacidad de renunciar a un protón.
Piruvato: El piruvato no puede renunciar a un protón.
Forma dominante
Ácido pirúvico: El ácido piruvico es el menos dominante forma en un entorno celular en comparación con el piruvato.
Piruvato: Pyruvato es el más dominante forma en un entorno celular en comparación con el ácido piruvico.
Intra-molecular Enlace de hidrógeno
Ácido pirúvico: El ácido pirúvico tiene un enlace de hidrógeno intra-molecular.
Piruvato: El piruvato no tiene un enlace de hidrógeno intra-molecular.
Referencias:
Cody, G. D., Boctor, N. Z., Filley, t. Riñonal., Hazen, R. METRO., Scott, J. H., Sharma, un. y Yoder, H. S. (2000). Compuestos primordiales de azufre carbonilados y la síntesis de piruvato. Ciencia, 289 (5483): 1337-1340.
Imagen cortesía: "Pyruvic-ácid-3D-Balls". (Dominio público) a través de Wikimedia Commons.

