Diferencia entre la ley de Raoult y la ley de Dalton
El diferencia clave Entre la ley de Raoult y la ley de Dalton es que La Ley de Raoult se ocupa de la presión de vapor de sólidos o líquidos, mientras que Dalton Law se ocupa de la presión parcial de los gases que no reaccionan.
La ley de Raoult y la ley de Dalton son leyes muy importantes en química que explican las presiones parciales de los estados gaseosos. La ley de Raoult describe el comportamiento de la presión parcial del vapor de una solución al cambiar la concentración de soluto. En contraste, la ley de Dalton describe el comportamiento de los gases no reaccionantes en el mismo recipiente.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la ley de raoult?
3. ¿Qué es la ley de Dalton?
4. Comparación de lado a lado - Ley de Raoult vs Dalton Law en forma tabular
6. Resumen
¿Qué es la ley de raoult??
La ley de Raoult afirma que la presión de vapor de un disolvente por encima de una solución es igual a la presión de vapor del disolvente puro a la misma temperatura escalada por la fracción molar del solvente presente en la solución. Podemos dar esta relación matemáticamente de la siguiente manera:
PAGsolución= Xsolvente.PAGOsolvente
Donde psoltuion es la presión de vapor de la solución, xsolvente es la fracción molar del solvente y POsolvente es la presión de vapor del solvente puro. La ley fue desarrollada por el químico francés, François-Marie Raoult en 1880. Descubrió que al agregar un soluto a una solución, la presión de vapor de la solución disminuye gradualmente. Sin embargo, esta observación dependía de dos variables: fracción molar del soluto disuelto y la presión de vapor del solvente puro.
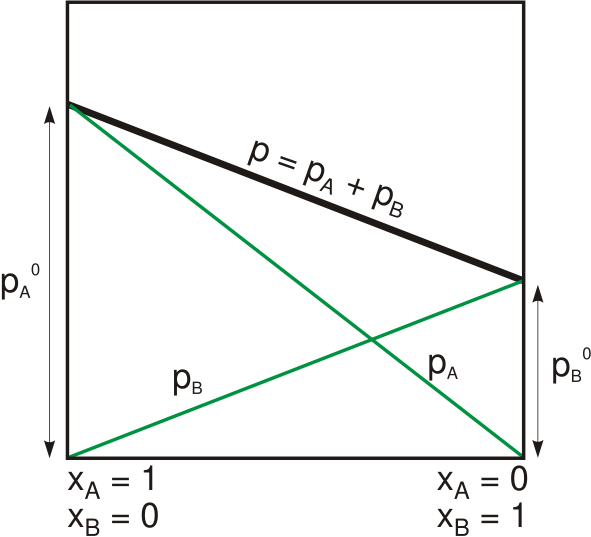
Figura 01: Presión de vapor de una solución binaria que sigue la ley de Raoult
A una presión dada para un sólido o líquido particular, hay una presión a la que el vapor de la sustancia está en equilibrio con la sustancia en forma sólida o líquida. A esa temperatura, nombramos la presión por encima de la sustancia como presión de vapor. Además, a este equilibrio, la velocidad de la evaporación de la sustancia sólida o líquida es igual al vapor que se condensa a la forma sólida o líquida. Por lo tanto, esta es la teoría básica detrás de la ley de Raoult. Sin embargo, Raoult Law funciona para soluciones ideales. Pero también funciona bien con solventes en un estado muy diluido. Para sustancias reales (no sustancias ideales), la disminución de la presión de vapor es prácticamente mayor que el valor que calculamos a partir de la ley Raoult.
¿Qué es la ley de Dalton??
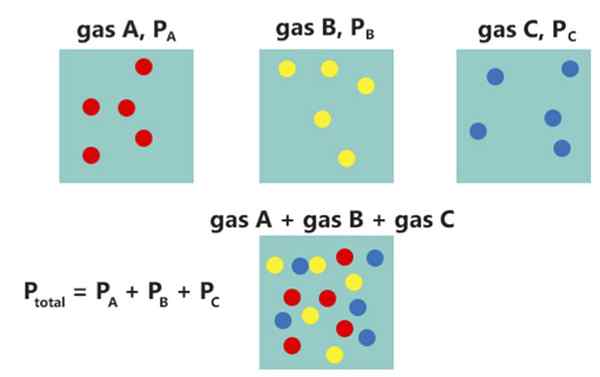
La ley de Dalton afirma que la presión total de una mezcla de gases no reaccionantes es igual a la suma de las presiones parciales de cada gas. La ley fue desarrollada por John Dalton en 1802. Podemos dar esta ley matemáticamente de la siguiente manera:
PAGtotal= Pi
Donde ptotal es la presión total de la mezcla de gas mientras Pi es la presión parcial de cada gas individual.

Figura 02: Dalton Law
Por ejemplo, si tenemos una mezcla de gases que no reaccionan con tres componentes, podemos escribir la relación de la siguiente manera:
PAGtotal = P1+PAG2+PAG3
¿Cuál es la diferencia entre Raoult Law y Dalton Law??
La ley de Raoult y la ley de Dalton son leyes muy importantes en química que explican las presiones parciales de los estados gaseosos. La diferencia clave entre la ley de Raoult y la ley de Dalton es que la ley de Raoult se ocupa de la presión de vapor de sólidos o líquidos, mientras que la ley de Dalton se ocupa de la presión parcial de los gases no relacionados. Eso es; La ley de Raoult establece que la presión de vapor de un disolvente por encima de una solución es igual a la presión de vapor del disolvente puro a la misma temperatura escalada por la fracción molar del solvente presente en la solución. Mientras tanto, la ley de Dalton establece que la presión total de una mezcla de gases no reaccionantes es igual a la suma de las presiones parciales de cada gas. La expresión matemática para la ley de raoult es psolución= Xsolvente.PAGOsolvente mientras que la expresión matemática para la ley de Dalton es Ptotal= Pi.

Resumen -Raoult Law vs Dalton Law
La ley de Raoult y la ley de Dalton son leyes muy importantes en química que explican las presiones parciales de los estados gaseosos. Sin embargo, la diferencia clave entre la ley de Raoult y la ley de Dalton es que la ley de Raoult se ocupa de la presión de vapor de sólidos o líquidos, mientras que la ley de Dalton se ocupa de la presión parcial de los gases no relacionados.
Referencia:
1. Helmenstine, Anne Marie. “Definición de la ley de Raoult en química."Thinkco, Jan. 9, 2019, disponible aquí.
Imagen de cortesía:
1. "Raoultov Zakon" (dominio público) a través de Commons Wikimedia
2. "Schematic que representa la ley de Dalton" de Blyumj - Trabajo propio (CC By -Sa 4.0) a través de Commons Wikimedia


