Diferencia entre la expresión de tasa y la ley de tasa

El diferencia clave entre la expresión de tasa y la ley de tasa es que La expresión de la velocidad da la tasa de apariencia o desaparición de productos o reactivos, mientras que la ley de la tasa da la relación entre la tasa y la concentración o la presión de los reactivos.
Cuando uno o más reactivos se convierten en productos, pueden pasar por diferentes modificaciones y cambios de energía. Los enlaces químicos en la ruptura de los reactivos, y se forman nuevos enlaces para generar productos que son totalmente diferentes de los reactivos. Esta modificación química se conoce como reacciones químicas. La expresión de la tasa y la ley de velocidad son conceptos químicos importantes que podemos describir en las reacciones químicas.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la expresión de tasa?
3. ¿Qué es la ley de tasas?
4. Comparación de lado a lado - Expresión de tasa vs Ley de velocidad en forma tabular
5. Resumen
¿Qué es la expresión de tasa??
La expresión de la velocidad es la forma de representar el cambio en la concentración de reactivos durante el tiempo de reacción. Podemos dar esta expresión utilizando cualquiera de los reactivos y productos de la reacción. Al dar la expresión de la velocidad con respecto a los reactivos, debemos usar un signo menos porque, durante la reacción, la cantidad del reactante disminuye con el tiempo. Al escribir la expresión de tasa usando productos, se utiliza el signo más porque la cantidad de productos aumenta con el tiempo.
Además, debemos considerar las relaciones estequiométricas al dar la expresión de la tasa para igualar toda la expresión de la tasa dada de cualquier manera. Por ejemplo, consideremos la siguiente reacción química y las expresiones de velocidad que podemos dar por ella;
2x +3y ⟶ 5Z
Las siguientes expresiones de velocidad son posibles para la reacción anterior:

¿Qué es la ley de tasas??
La ley de la velocidad es la expresión matemática de la velocidad de una reacción que incluye la relación entre la velocidad de los reactivos y la velocidad del producto. Podemos determinar estos datos matemáticos experimentalmente, y también podemos verificar la relación. Hay dos formas principales en que podemos escribir una ley de tasas; Ley de tasas diferenciales y ley de tarifas integradas.
Ley de tasas diferenciales
La ley de velocidad diferencial es la forma de expresar la velocidad de reacción utilizando el cambio en la concentración de uno o más reactivos. Aquí, consideramos el cambio de la concentración de los reactivos durante un período de tiempo específico. Nombre este intervalo de tiempo como ΔT. Podemos nombrar el cambio en la concentración del reactivo "R" como δ [R]. Consideremos un ejemplo para comprender cómo escribir una ley de tasas diferenciales. Para una reacción en la que el reactivo "A" se descompone para dar los productos y K es la velocidad constante, mientras que n es el orden de esta reacción, entonces la ecuación para esta velocidad es la siguiente:
- A ⟶ Productos
La ley de tasa diferencial es la siguiente:
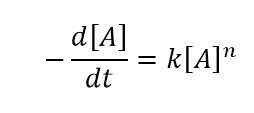
Ley de tasas integrada
La ley de tasa integrada es la forma de expresar la velocidad de reacción en función del tiempo. Podemos obtener esta expresión utilizando la ley de tasa diferencial a través de la integración de la ley de tasa diferencial. Podemos obtener esta ley de tasa integrada de una tasa ordinaria también.
Por ejemplo, para la reacción A ⟶ Productos, la ley de tasa ordinaria es la siguiente:
Tasa (r) = k [a]
donde k es la velocidad constante y [a] es la concentración del reactante A. Si consideramos un pequeño intervalo de tiempo, podemos escribir la ecuación anterior de la siguiente manera:
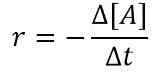
Usamos el signo menos (-) aquí porque A es el reactivo y con el tiempo creciente, la concentración de A disminuye. Entonces podemos obtener una relación de la siguiente manera combinando las dos ecuaciones anteriores;
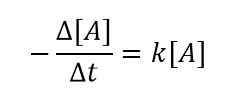
Para un cambio muy pequeño en la concentración de reactivos en un intervalo de tiempo muy pequeño, podemos escribir la ecuación como se muestra a continuación;
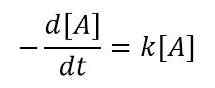
O
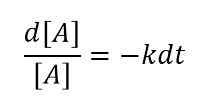
Luego, al integrar esta ecuación, podemos obtener la siguiente relación:
ln [a] = -kt +constante
Por lo tanto, cuando el tiempo es cero o t = 0, ln [a] es la concentración inicial de un reactivo (podemos darlo como [a]0) Dado que en t = 0, -kt = 0 entonces ln [a]0= constante. Para una reacción de primer orden, la ley de velocidad integrada es,
ln [a] = ln [a]0 - kt
¿Cuál es la diferencia entre la expresión de tasa y la ley de tasa??
La expresión de la velocidad y la velocidad AW son dos formas de dar detalles sobre la velocidad de una reacción. La diferencia clave entre la expresión de la velocidad y la ley de velocidad es que la expresión de la velocidad da la tasa de apariencia o desaparición de productos o reactivos, mientras que la ley de tasa da la relación entre la tasa y la concentración o la presión de los reactivos.
Debajo de la infografía resume la diferencia entre la expresión de tasa y la ley de tasa.
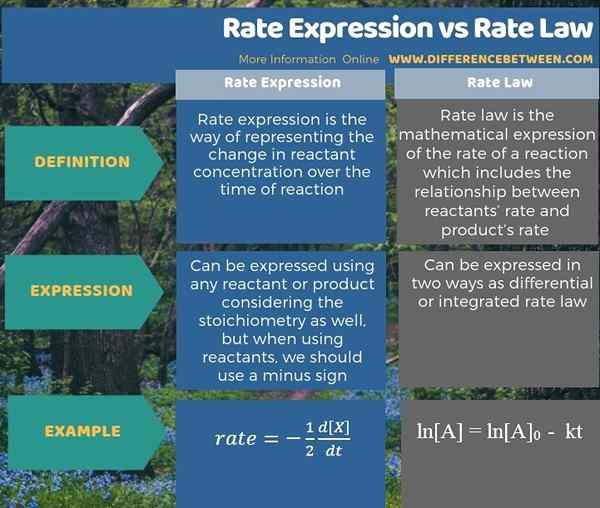
Resumen -Expresión de tasa frente a la ley de tasas
La ley de expresión y velocidad de la tasa son dos formas de dar detalles sobre la velocidad de una reacción. La diferencia clave entre la expresión de la velocidad y la ley de velocidad es que la expresión de la velocidad da la tasa de apariencia o desaparición de productos o reactivos, mientras que la ley de tasa da la relación entre la tasa y la concentración o la presión de los reactivos.
Referencia:
1. "Reducir la expresión y el orden de reacción." LinkedIn Slideshare, 15 de septiembre. 2013, disponible aquí.


