Diferencia entre la ley de tasas y la ley de la acción masiva
Diferencia clave - Ley de tasas versus ley de acción masiva
El diferencia clave entre la ley de tasas y la ley de la acción masiva es que La ley de la velocidad indica la relación entre la velocidad de una reacción química y las concentraciones de reactivos, mientras que la ley de acción masiva establece que la velocidad de una reacción química es proporcional a las masas de las sustancias reaccionantes.
La ley de tasa es una ley de química que se utiliza para explicar el comportamiento de una mezcla de reacción. La ley de la velocidad indica que la velocidad de una reacción es directamente proporcional a la velocidad de reacción. La constante de proporcionalidad se conoce como la constante de velocidad. La ley de acción de masa indica que la velocidad de reacción de una reacción química es directamente proporcional al producto de masas de reactivos que se elevan a una potencia (a menudo es igual a su coeficiente estequiométrico en la ecuación química) que se determina experimentalmente experimentalmente.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la ley de tasas?
3. ¿Qué es la ley de acción masiva?
4. Comparación de lado a lado - Ley de tasas versus ley de acción masiva en forma tabular
5. Resumen
¿Qué es la ley de tasas??
La ley de la velocidad indica la relación entre la velocidad de una reacción química y las concentraciones de reactivos. De acuerdo con la ley de la velocidad, la velocidad de una reacción es directamente proporcional a las concentraciones de reactivos que se elevan a un poder (a menudo es igual a la relación estequiométrica en la ecuación química) que se determina experimentalmente.
La ley de tarifas se puede encontrar en dos tipos de la siguiente manera:
- Ley de tasas diferenciales
La ley de velocidad diferencial da la velocidad de una reacción en función del cambio en la concentración de reactivos durante un período de tiempo particular.
- Ley de tasas integrada
La ley de velocidad integrada da la velocidad de una reacción en función de la concentración inicial de un reactivo en un período de tiempo específico.
Consideremos un ejemplo para entender esto.
AA +BB → CC +DD
Tasa = k [a]a[B]b
La ecuación anterior da la expresión matemática de la ley de tasas. Allí, "k" es una constante de proporcionalidad. Se conoce como la constante de tasa. Los exponentes "A" y "B" son las órdenes de reacción con respecto al reactivo A y B respectivamente. La orden general (P) de la reacción se da como la suma de todas las órdenes en la ecuación de la ley de tasa.
P = A + B

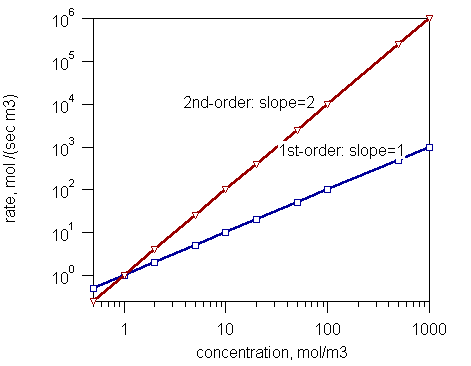
Figura 1: La velocidad de reacción y la concentración de reacciones de primer orden y reacciones de segundo orden.
Según el orden general de una reacción, las reacciones están en tres tipos como:
- Reacciones de orden cero: la velocidad de reacción es independiente de la concentración de reactivos
- Reacciones de primer orden: la velocidad de reacción es proporcional a la concentración de un reactivo.
- Reacciones de segundo orden: la velocidad de reacción es proporcional al producto de concentraciones de dos reactivos o al cuadrado de la concentración de un reactivo.
¿Qué es la ley de acción masiva??
La ley de la acción de la masa indica que la velocidad de una reacción química es proporcional a las masas de las sustancias reaccionantes. También se conoce como el ley de acción masiva. Esta ley es útil para obtener la ecuación de equilibrio precisa de una reacción química particular. La ley también es dada por actividades o concentraciones de reactivos. Según la ley de acción de masa, la relación entre las concentraciones de productos y reactivos es una constante en una mezcla de reacción que está en estado de equilibrio.
La ley de la acción masiva es un concepto universal, lo que significa que es aplicable a cualquier sistema bajo cualquier circunstancia. Esta ley se puede dar en una expresión matemática como se muestra a continuación.
Para la reacción,
AA +BB ↔ CC +DD
La relación entre productos y reactivos en equilibrio;
Keq = [c]C[D]d / [A]a[B]b
A una temperatura dada, la relación anterior es una constante para el equilibrio entre los reactivos (A y B) y los productos (C y D). Aquí, Keq se conoce como la constante de equilibrio.
¿Cuál es la diferencia entre la ley de tasas y la ley de la acción masiva??
Ley de tasas versus ley de acción masiva | |
| La ley de la velocidad indica que la velocidad de una reacción es directamente proporcional a las concentraciones de reactivos que se elevan a un poder que se determina experimentalmente. | La ley de la acción de la masa indica que la velocidad de una reacción química es proporcional a las masas de las sustancias reaccionantes. |
| Componentes de la ecuación | |
| La ecuación de la ley de velocidad tiene una constante constante, concentraciones de reactivos y el orden de reacción. | La ley de la acción masiva tiene una ecuación compuesta por concentraciones de productos y reactivos elevados al poder de su coeficiente estequiométrico. |
| Producto | |
| La ecuación de la ley de tasas no contiene concentraciones de productos. | La ecuación de la Ley de Acción Masa contiene las concentraciones de productos. |
| Componente de proporcionalidad | |
| La constante de proporcionalidad de la ecuación de la ley de tasas se conoce como la constante de tasa "K". | No hay constante de proporcionalidad en la ley de la ecuación de acción masiva. |
Resumen - Ley de tasas vs Ley de Acción Masa
Las leyes de calificación y la ley de la acción masiva se utilizan para explicar el comportamiento de una mezcla de reacción. La diferencia clave entre la ley de la velocidad y la ley de la acción de la masa es que la ley de la velocidad indica la relación entre la velocidad de una reacción química y las concentraciones de reactivos, mientras que la ley de acción de masa indica que la velocidad de una reacción química es proporcional a las concentraciones de las sustancias reaccionantes.
Referencia:
1. "La ley de tasas."Química Biblioteca, 21 de julio de 2016, disponible aquí.
2. "12.3 leyes de tarifas."Química, disponible aquí.
3. Laidler, Keith J. "Ley de acción masiva."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 26 de octubre. 2016, disponible aquí.
Imagen de cortesía:
1. "Rateloglogplot" de Fabiuccio ~ enwikibooks en English Wikibooks - Transferido desde EN.wikibooks a los comunes., (Dominio público) a través de Commons Wikimedia


