Diferencia entre las reacciones redox y no redox

El diferencia clave entre las reacciones redox y no redox es que En las reacciones redox, el estado de oxidación de algunos elementos químicos cambia de un estado a otro estado, mientras que, en las reacciones no redox, los estados de oxidación de los elementos químicos no cambian.
Las reacciones redox y no redox son dos tipos principales de reacciones químicas. Estos dos grupos difieren entre sí dependiendo de los cambios que suceden con los estados de oxidación de los elementos químicos de los cuales están hechos los reactivos.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son las reacciones redox?
3. ¿Cuáles son las reacciones no redox?
4. Comparación de lado a lado: reacciones redox vs no redox en forma tabular
5. Resumen
¿Qué son las reacciones redox??
La reacción redox es un tipo de reacción química en la que se producen medias reacciones de oxidación y reducción simultáneamente. En esta reacción, consideramos la oxidación y la reducción como procesos complementarios. Aquí, la oxidación es la pérdida de electrones o el aumento en el estado de oxidación, mientras que la reducción es la ganancia de electrones o disminución del estado de oxidación. El término "redox" es una forma corta de los procesos de reducción de oxidación.
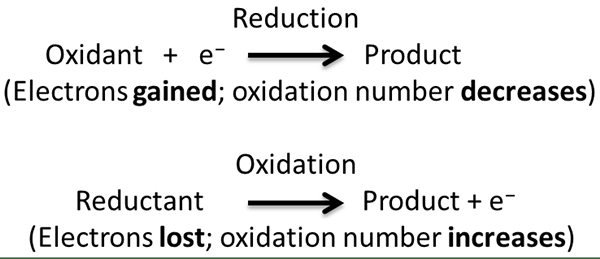
Durante una reacción redox, el compuesto/reactivo químico que se somete a la reducción se llama agente oxidante, mientras que el compuesto que está experimentando oxidación se llama agente reductor. Esto se debe a que el agente oxidante hace que el otro compuesto se someta a oxidación y viceversa.
En una reacción redox, lo que realmente sucede es la transferencia de electrones entre dos reactivos a través de medias reacciones. Podemos identificar fácilmente esta transferencia de electrones al observar los estados de oxidación de los elementos químicos. Durante la transferencia de electrones, el estado de oxidación aumenta si se pierden electrones porque deja protones desequilibrados en los átomos, y el estado de oxidación disminuye cuando se obtienen electrones porque los electrones son cargas negativas de partículas subatómicas. Existen diferentes tipos de reacciones redox, como reacciones de descomposición, reacciones de combinación, reacciones de desplazamiento y reacciones de desproporción.
¿Cuáles son las reacciones no redox??
Las reacciones nnonredox son reacciones químicas donde no se producen cambios en los estados de oxidación de los elementos químicos. Por lo tanto, estas reacciones químicas no tienen medias reacciones para la oxidación y reducción como en las reacciones redox. En otras palabras, hay transferencias de electrones que ocurren durante la progresión de la reacción química.

Figura 02: reacción de neutralización de NaOH y HCL
Ejemplos comunes de reacciones que no son REDOX incluyen reacciones de neutralización y reacciones de doble desplazamiento.
¿Cuál es la diferencia entre las reacciones redox y no redox??
Las reacciones redox y no redox son dos tipos diferentes de reacciones químicas. La diferencia clave entre las reacciones redox y no redox es que en las reacciones redox, el estado de oxidación de algunos elementos químicos cambia de un estado a otro estado, mientras que, en las reacciones no redox, los estados de oxidación de los elementos químicos no cambian. Además, las reacciones redox tienen medias reacciones de oxidación y medias reacciones de reducción, mientras que no se pueden observar medias reacciones particulares en las reacciones no redox. Reacciones de descomposición, reacciones de desplazamiento, reacciones de desproporción, etc. son ejemplos de reacciones redox, mientras que las reacciones de neutralización, reacciones de doble desplazamiento, etc. son ejemplos de reacciones no redox.
La siguiente infografía tabula las diferencias entre las reacciones redox y no redox.

Resumen -Reacciones redox vs no redox
Las reacciones redox y no redox son dos tipos diferentes de reacciones químicas. La diferencia clave entre las reacciones redox y no redox es que en las reacciones redox, el estado de oxidación de algunos elementos químicos cambia de un estado a otro estado, mientras que, en las reacciones no redox, los estados de oxidación de los elementos químicos no cambian.
Referencia:
1. "Reacciones de reducción de oxidación." Bibliotecas de química, Libretexts, 15 de agosto. 2020, disponible aquí.
Imagen de cortesía:
1. "Holes redox" de Cameron Garnham - Trabajo propio (CC By -SA 3.0) a través de Commons Wikimedia
2. "Reacción de neutralización entre hidróxido de sodio y ácido clorhídrico" por Bluescan SV.wiki - trabajo propio (cc by -sa 3.0) a través de Commons Wikimedia


