Diferencia entre los elementos de bloque S y P
Diferencia clave -S vs. Elementos de bloque P
El diferencia clave Entre los elementos de bloque S y P se pueden explicar mejor utilizando su configuración electrónica. En los elementos de bloque S, el último electrón se llena en la subshell S y en los elementos del bloque P, el último electrón se llena en la subshell P. Cuando forman iones; Los elementos de bloques S Elimine fácilmente sus electrones de la subshell S más externa, mientras que los elementos de bloque P aceptan electrones en la subshell P o eliminan los electrones de la subprota P. Algunos elementos en el grupo P forman iones positivos que eliminan electrones de la subpena P más externa y algunos elementos (los elementos más electronegativos) forman iones negativos que aceptan un electrón de otros. Cuando considera las propiedades químicas, hay una diferencia significativa entre los elementos de bloque S y P; Esto se debe básicamente a la configuración de electrones.
¿Qué son los elementos de bloqueo S?
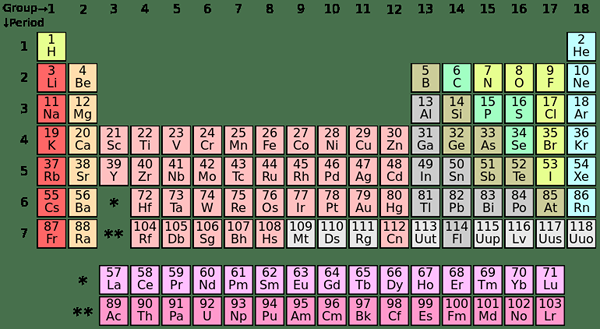
Los elementos de bloque S son los elementos químicos en el Grupo I y el Grupo II en la tabla periódica. Dado que la subshell S puede acomodar solo dos electrones, estos elementos generalmente tienen uno (grupo I) o dos electrones (grupo II) en la carcasa más externa. Los elementos en el grupo I y II se muestran arriba en la tabla.
| I A | II A | |
| 2 | Li | Ser |
| 3 | N / A | Mg |
| 4 | K | California |
| 5 | RB | Sr |
| 6 | CS | Licenciado en Letras |
| 7 | Fría | Real academia de bellas artes |
| I A | Metales alcalinos |
| II A | Metales de la tierra alcalina |
Todos los elementos en el bloque S forman iones positivos y son muy reactivos.

La colocación de los elementos de bloque S en la tabla periódica
¿Qué son los elementos de bloque P-Bloque??
Los elementos de bloque P son los elementos cuyo último electrón se llena en la subshell P. Hay tres orbitales P; Cada orbital puede acomodar dos electrones, lo que hace que el total de seis electrones P. Por lo tanto, los elementos de bloque P tienen uno a seis electrones P en su carcasa más externa. El bloque P contiene tanto metales como no metales; Además también hay algunos metaloides.
| 13 | 14 | 15 | dieciséis | 17 | 18 | |
| 2 | B | C | norte | O | F | Nordeste |
| 3 | Alabama | Si | PAG | S | CL | Arkansas |
| 4 | Georgia | Ge | Como | SE | BR | KR |
| 5 | En | Sn | SB | TE | I | Xe |
| 6 | TL | PB | Bi | Correos | En | RN |
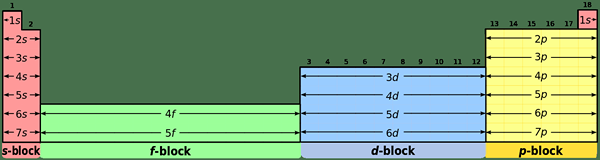
¿Cuál es la diferencia entre los elementos de bloque S y P?
Configuración de electrones comunes:
Elementos de bloque S: Los elementos de bloque S tienen la configuración de electrones común de [Noble Gas] NS1 (para elementos del grupo I) y [gas noble] ns2 (para elementos del Grupo II).
Elementos de bloque P: Los elementos de bloque P tienen la configuración de electrones común de [Noble Gas] NS2 notario público1-6. Pero, helio tiene 1s2 configuración; Es una situación especial.
Estados de oxidación:
Elementos de bloque S: Los elementos de bloque S no muestran múltiples estados de oxidación como los elementos de bloque P. Por ejemplo, los elementos del Grupo I muestran +1 Elementos de oxidación y los elementos del Grupo II muestran +2 Estado de oxidación.
Elementos de bloque P: A diferencia de los elementos de bloque S, los elementos de bloque P tienen un estado de oxidación común para su grupo respectivo en la tabla periódica y algunos otros estados de oxidación adicionales dependiendo de la estabilidad del ion.
| Grupo | 13 | 14 | 15 | dieciséis | 17 | 18 |
| Configuración general de electrones | ns2notario público1 | ns2notario público2 | ns2notario público3 | ns2notario público4 | ns2notario público5 | ns2notario público6 |
| 1calle miembro del grupo | Ser | C | norte | O | F | Él |
| Número de oxidación común | +3 | +4 | +5 | -2 | -1 | 0 |
| Otros estados de oxidación | +1 | +2, -4 | +3, -3 | +4, +2, | +3, +5, +1, +7 | - |
Propiedades:
Elementos de bloque S: En general, todos los elementos de bloque S son metales. Son conductores eléctricos y calientes brillantes, buenos y fáciles de eliminar los electrones de la carcasa de valencia. Son los elementos más reactivos en la tabla periódica.
Elementos de bloque P: La mayoría de los elementos de bloque P no son metales. Tienen bajos puntos de ebullición, conductores pobres y difícil de eliminar los electrones de la carcasa más externa. En cambio, ganan electrones. Algunos de los no metales son sólidos (C, P, S, SE) a temperatura ambiente, mientras que algunos son gases (oxígeno, nitrógeno). El bromo no es metal, y es un líquido a temperatura ambiente.
Además, el bloque P contiene algunos elementos metálicos; Aluminio (Al), Gallium (GA), Indium (in), Tin (Sn), Thallium (TL), Lead (Pb) y Bismuth (BI).
Imagen de cortesía:
1. "Tabla periódica (poliatómica)" de Depiep [CC BY-SA 3.0] a través de Commons
2. "Bloques de tabla periódicos SPDF (32 columna)" por el usuario: Depiep [CC BY-SA 3.0] a través de Commons


