Diferencia entre la solución saturada y concentrada
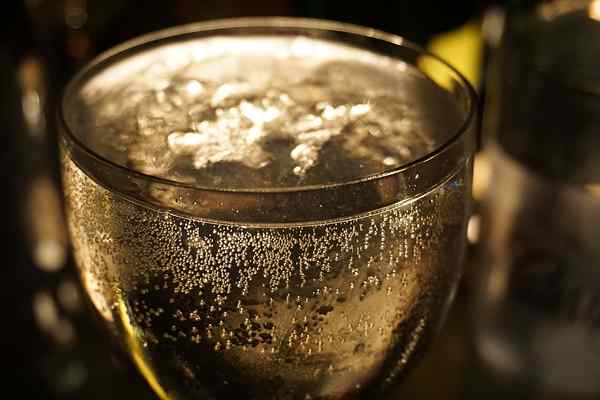
Diferencia clave: saturado VS Conceptontrado Solución
Una solución es una fase líquida de la materia que se forma disolviendo un soluto en un solvente. Se puede convertir una solución en una solución saturada agregando más solutos hasta que no se puedan disolver más solutos. Una solución concentrada contiene una cantidad considerablemente alta de solutos, pero esa cantidad no es la máxima. El diferencia clave entre la solución saturada y concentrada es que Los solutos adicionales no se pueden disolver en una solución saturada ya que contiene la cantidad máxima de solutos, mientras que los solutos adicionales se pueden disolver en una solución concentrada porque no contiene la cantidad máxima de solutos (no saturados con el soluto).
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la solución saturada?
3. ¿Qué es la solución concentrada?
4. Similitudes entre la solución saturada y concentrada
5. Comparación lado a lado: solución saturada vs concentrada en forma tabular
6. Resumen
¿Qué es la solución saturada??
Una solución saturada es una solución química que contiene la concentración máxima de un soluto disuelto en el solvente. Los solutos adicionales no se pueden disolver en una solución saturada ya que contiene la cantidad máxima de solutos. La forma opuesta de la solución saturada es la solución insaturada. La solución insaturada no está saturada con el soluto. Una solución insaturada puede ser una solución concentrada o una solución diluida.
Hay varios factores que afectan la saturación de una solución. Estos factores afectan la disolución de solutos en el solvente.
- Temperatura: la solubilidad de los compuestos sólidos aumenta al aumentar la temperatura del solvente. Por lo tanto, se pueden disolver más solutos en el solvente caliente en lugar de en el solvente frío.
- Presión: más solutos pueden ser fuerzas para disolverse en el solvente aplicando presión. Por lo tanto, la disolución de solutos se puede aumentar aumentando la presión del sistema. Ej: gases.
- Composición química: si algunos otros solutos ya están presentes en la solución, afecta la solubilidad de los solutos.
Se puede producir una solución saturada agregando un soluto al solvente hasta que no se disuelvan más solutos. O bien, se puede hacer evaporando el solvente de solución hasta que el soluto comience a formar cristales. Otro método, aunque no es tan común, es agregar semillas de cristales a una solución sobresaturada. Una solución sobresaturada contiene muchos solutos que permanecen disueltos incluso si la solución se enfría. Cuando se agregan semillas de cristales a esta solución sobresaturada, los solutos comienzan a cristalizar, dando una solución saturada.
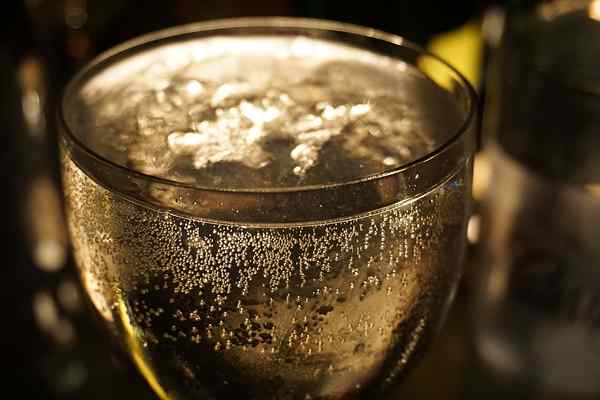
Figura 01: los jugos brillantes son soluciones saturadas
Algunos ejemplos de soluciones saturadas incluyen agua carbonatada (saturada de carbono), soluciones de azúcar saturadas (no se puede disolver más azúcar), la cerveza o los jugos brillantes están saturados de dióxido de carbono, etc.
¿Qué es la solución concentrada??
Una solución concentrada es una solución química que contiene una gran cantidad de un soluto disuelto en el solvente. Los solutos adicionales se pueden disolver en una solución concentrada porque no contiene la cantidad máxima de solutos (no saturados con el soluto). La forma opuesta de la solución concentrada es la solución diluida. Una solución diluida contiene una cantidad relativamente baja de solutos disueltos en un disolvente.

Figura 02: Una solución concentrada (derecha) tiene un color fuerte en comparación con una solución diluida (izquierda)
Las soluciones concentradas de ácidos o bases se reconocen como ácidos fuertes o bases fuertes. En contraste, los ácidos o bases diluidos son ácidos o bases débiles. El término concentrado se usa para dar una idea cuantitativa sobre una solución. Se puede formar una solución concentrada disolviendo más solutos en una solución o evaporando una solución hasta que se evapore una cantidad considerable de solvente dejando solutos en la solución. La concentración de una solución se puede administrar a continuación. Allí la concentración viene dada por la unidad mol/l.
Concentración = número de moles de solutos / volumen de la solución
¿Cuáles son las similitudes entre la solución saturada y concentrada??
- Tanto la solución saturada como las concentradas son soluciones que contienen una gran cantidad de solutos
- Los términos de solución saturados y concentrados expresan una idea cuantitativa sobre las soluciones.
¿Cuál es la diferencia entre la solución saturada y concentrada??
Solución saturada vs concentrada | |
| Una solución saturada es una solución química que contiene la concentración máxima de un soluto disuelto en el solvente. | Una solución concentrada es una solución química que contiene una gran cantidad de un soluto disuelto en el solvente. |
| Cantidad de solutos | |
| La solución saturada contiene la cantidad máxima de solutos que puede contener. | La solución concentrada contiene una cantidad considerablemente alta de solutos. |
| Adición de más solutos | |
| Los solutos adicionales no se pueden disolver en una solución saturada ya que contiene el máximo. | Los solutos adicionales se pueden disolver en una solución concentrada porque no contiene la cantidad máxima de solutos (no saturados con el soluto). |
| Forma opuesta | |
| La forma opuesta de solución saturada es la solución insaturada. | La forma opuesta de solución concentrada es la solución diluida. |
| Ejemplos | |
| Algunos ejemplos de soluciones saturadas incluyen agua carbonatada, soluciones de azúcar saturadas, cerveza o jugos brillantes están saturados de dióxido de carbono, etc. | Algunos ejemplos de soluciones concentradas incluyen ácidos concentrados y bases concentradas utilizadas en laboratorios. |
Resumen -Saturado VS Conceptontrado Solución
Una solución saturada es una forma de una solución concentrada, pero contiene la cantidad máxima de solutos que pueden contener. La diferencia entre la solución saturada y concentrada es que los solutos adicionales no se pueden disolver en una solución saturada ya que contiene la cantidad máxima de solutos, mientras que los solutos adicionales se pueden disolver en una solución concentrada porque no contiene la cantidad máxima de solutos (no saturados con el soluto).
Referencia:
1."13.2: Soluciones saturadas y solubilidad."Bibliotecas de química, Librettexts, 8 de octubre. 2017. Disponible aquí
2."Cómo concentrar una solución."Sciencing. Disponible aquí
3.Helmenstine, Anne Marie, D. “Definición de solución saturada y ejemplos."Thinkco, junio. 20, 2017. Disponible aquí
Imagen de cortesía:
1.'2980956' por Nicole_80 (dominio público) a través de Pixabay
2.'Riboflavinsolution'by sbharris - trabajo propio, (cc by -sa 3.0) a través de Commons Wikimedia


