Diferencia entre la solución saturada y sobresaturada

Diferencia clave: solución saturada vs supersaturada
Primero veamos brevemente el concepto de saturación antes de pasar a un análisis complejo de la diferencia entre la solución saturada y sobresaturada. Las soluciones se hacen disolviendo un soluto en un solvente. Las dos propiedades químicas de "saturación" y "supersaturación" en solventes dependen principalmente de la solubilidad del soluto en el solvente. A una temperatura dada, la solubilidad de un soluto en un solvente particular es una constante (Q).
Q se define como el producto iónico del soluto.
Ejemplo: Solubilidad de AGCL en agua (QAGCL) = [AG+] [CL-]
En general, si seguimos agregando el soluto al solvente, hay una cantidad máxima que podemos agregar disuelto en el solvente. Después de un cierto límite, el soluto comienza a precipitar en el solvente. Se convierte en una solución sobresaturada después de este límite. Se llama una solución saturada cuando podemos disolver el soluto sin formación de un precipitado.
El diferencia clave entre La saturación y la sobresaturación es que, La saturación es el estado en el que una solución de una sustancia no puede disolver más de esa sustancia, y las cantidades adicionales aparecerán como una fase separada, mientras que la superesaturación es un estado de solución que contiene más material disuelto de lo que podría disolverse el solvente en circunstancias normales.
¿Qué es una solución saturada??
Hay un número muy limitado de compuestos que son infinitamente solubles en un solvente; lo que significa que podemos mezclar el soluto en el solvente en cualquier proporción para disolver sin formar un precipitado. Sin embargo, la mayoría de los solutos no son infinitamente insolubles; forman un precipitado si agrega más soluto al solvente.
Las soluciones saturadas contienen el número máximo de moléculas de soluto que puede disolver sin precipitación.
¿Qué es una solución sobresaturada??
Se forman soluciones sobresaturadas si agrega soluto adicional a la solución saturada. En otras palabras, es la condición en una solución saturada, cuando agrega cierta cantidad adicional de soluto en la solución. Luego comenzará a formar un precipitado en la solución porque el solvente ha excedido la cantidad máxima de moléculas de soluto que puede disolver. Si eleva la temperatura del solvente, puede hacer una solución saturada disolviendo las moléculas de soluto.

La sobresaturación del azúcar en el agua permite que se formen dulces de roca.
¿Cuál es la diferencia entre la solución saturada y sobresaturada??
Definición de solución saturada y sobresaturada
Solución saturada: A una temperatura particular, se dice que una solución es una solución saturada, si contiene tanto como las moléculas de soluto que el disolvente puede contener.
Solución supersaturada: A una temperatura particular se dice que una solución es una solución sobresaturada si contiene más moléculas de soluto que puede disolver.
Explicación química
Para soluciones saturadas; Q = Ksp (Sin precipitación)
Para soluciones sobresaturadas; Q> ksp (El precipitado se formará)
Dónde;
Q = solubilidad (cociente de reacción)
K sp= Producto de solubilidad (Producto matemático de concentraciones de iones disueltos elevados al poder de sus coeficientes estequiométricos)
Ejemplo: Considere disolver el cloruro de plata (AGCL) en agua.
AGCL - SOLUTE Y AGUA - Solvente

AGCL se ha disuelto en agua, una gran cantidad de AGCL se ha disuelto en agua.
La solución está clara, el precipitado es claramente visible
Q = [AG+] [CL-] = Ksp Q = [AG+] [CL-]> Ksp
Dónde,
[AG+] = Concentración de AG+ en agua
[CL-] = Concentración de cl- en agua
Para agcl, ksp = 1.8 × 10-10 moles2dm-6
¿Cómo podemos hacer soluciones saturadas y sobresaturadas??
Las soluciones saturadas y supersaturadas se forman cuando sigue agregando un soluto particular a un solvente. A una temperatura dada, primero, forma una solución insaturada y luego, una solución saturada y finalmente la solución sobresaturada.
Ejemplo: Disolviendo sal en agua
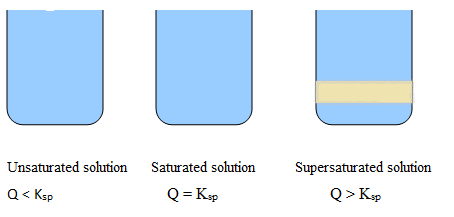 Solución no saturada: Menos cantidad de sal en agua, solución clara, sin precipitación.
Solución no saturada: Menos cantidad de sal en agua, solución clara, sin precipitación.
Solución saturada: La cantidad máxima de sal se disuelve en agua, el color de la solución cambia ligeramente, pero no hay precipitación.
Solución sobresaturada: Más sal se disuelve en agua, solución turbia, la precipitación es visible.
Imagen de cortesía:
"Rock-candy-sticks" de Evan-Amos-Trabajo propio. (CC BY-SA 3.0) Vía Commons


